题目内容
如图烧杯中盛有稀硫酸,则:
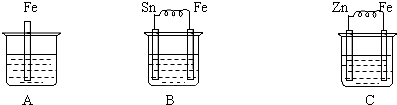
(1)B中各电极的电极反应式:负极 .
(2)C中被腐蚀的金属是 ,正极反应式为 .
(3)三烧杯中铁被腐蚀的速率由快到慢的顺序是 .

(1)B中各电极的电极反应式:负极
(2)C中被腐蚀的金属是
(3)三烧杯中铁被腐蚀的速率由快到慢的顺序是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)B为原电池,铁做负极,失去电子发生氧化反应,锡做正极,氢离子在正极得到电子发生还原反应;
(2)C为原电池,锌活泼性强于铁,做负极,发生氧化反应先被腐蚀,氢离子在正极上得到电子发生还原反应;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
(2)C为原电池,锌活泼性强于铁,做负极,发生氧化反应先被腐蚀,氢离子在正极上得到电子发生还原反应;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答:
解:(1)B为原电池装置,Fe较活泼,做原电池的负极,发生氧化反应,电极方程式为Fe=Fe2++2e,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑,
故答案为:Fe=Fe2++2e;
(2)Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Zn;2H++2e-=H2↑;
(3)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为B>A>C,
故答案为:B>A>C.
故答案为:Fe=Fe2++2e;
(2)Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Zn;2H++2e-=H2↑;
(3)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为B>A>C,
故答案为:B>A>C.
点评:本题考查金属的电化学腐蚀与防护,题目难度不大,明确原电池工作原理、准确判断电池的正负极是解题关键,注意金属的电化学腐蚀与化学腐蚀的区别,以及金属腐蚀快慢的顺序.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.下列说法正确的是( )
| A、未加入稀盐酸之前c( CN-)>c(HCN) | ||
B、加稀盐酸后溶液中
| ||
| C、pH=7时,溶液中c( Na+)=c( CN-) | ||
| D、加稀盐酸后HCN的电离程度减小,但c( H+)增大 |
制造光导纤维的主要原料是( )
| A、晶体硅 | B、二氧化硅 |
| C、石墨 | D、硅酸钠 |
aXn-和bYm+为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )
| A、Y最高价氧化物的化学式为YOm |
| B、a+n=b-m |
| C、原子半径:X<Y |
| D、X的氢化物的化学式为HnX |
在标准状况下,相同质量的下列气体中体积最大的是( )
| A、H2 |
| B、N2 |
| C、Cl2 |
| D、CO2 |