题目内容
下列说法中错误的是( )
| A、手性催化剂主要催化一种手性分子的合成 |
| B、原子晶体的熔点一定比金属晶体的高 |
| C、元素电负性越大的原子,吸引电子的能力越强 |
| D、原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系,元素电离能、电负性的含义及应用,原子晶体
专题:化学键与晶体结构
分析:A、手性催化剂具有选择性;
B、原子晶体的熔点不一定比金属晶体的高;
C、电负性是用来描述不同元素原子对键合电子吸引力的大小;
D、原子晶体的物理性质由共价键决定.
B、原子晶体的熔点不一定比金属晶体的高;
C、电负性是用来描述不同元素原子对键合电子吸引力的大小;
D、原子晶体的物理性质由共价键决定.
解答:
解:A、手性催化剂具有选择性,主要催化一种手性分子的合成,故A正确;
B、原子晶体熔点不一定比金属晶体高,如金属钨熔点3000°C以上,晶体硅的熔点在1400°C左右,故B错误;
C、电负性是用来描述不同元素原子对键合电子吸引力的大小,元素电负性越大的原子,吸引电子的能力越强,故C正确;
D、原子晶体中原子以共价键结合,共价键的键能较大,所以原子晶体的熔点高、硬度大,故D正确.
故选B.
B、原子晶体熔点不一定比金属晶体高,如金属钨熔点3000°C以上,晶体硅的熔点在1400°C左右,故B错误;
C、电负性是用来描述不同元素原子对键合电子吸引力的大小,元素电负性越大的原子,吸引电子的能力越强,故C正确;
D、原子晶体中原子以共价键结合,共价键的键能较大,所以原子晶体的熔点高、硬度大,故D正确.
故选B.
点评:本题考查了手性催化剂、原子晶体和金属晶体、电负性等,主要考查学生对有关概念的理解,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.3mol/L NaCl溶液含离子总数为0.6NA |
| B、常温常压下,18g H2O中含有的电子数总数为10NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、1L 2 mol/L Na2CO3溶液中含有的CO32-数目为4NA |
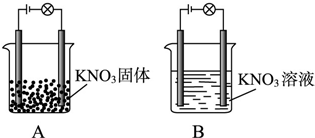 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是( )
| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |
关于0.1mol/L H2SO4溶液的叙述错误的是( )
| A、1L该溶液中含有H2SO4的质量为9.8g |
| B、0.5L该溶液中氢离子的物质的量浓度为0.2mol/L |
| C、从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度为0.01mol/L |
| D、取该溶液10mL,加水稀释至100mL后H2SO4的物质的量浓度为0.01mol/L |
反应NH4HS(s)?NH3(g)+H2S(g),在某一温度下达到平衡.下列各种情况中,不能使化学平衡发生移动的是( )
| A、其他条件不变时通入SO2气体 |
| B、移走一部分NH4HS固体 |
| C、容器体积不变,充入N2 |
| D、压强不变时,充入N2 |
在长途运输香蕉、苹果、橙子等新鲜水果时,常常在盛放水果的集装箱里放置浸泡有KMnO4酸性溶液的硅藻土,其中KMnO4酸性溶液的作用是( )
| A、杀死细菌,防止水果腐烂 |
| B、吸收氧气,防止水果被氧化变色 |
| C、吸收水果产生的乙烯,防止水果早熟 |
| D、除去有害气体,防止水果被污染 |