题目内容
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
我们跟踪测定H2O的物质的量浓度,
如图所示:
则0~20min的反应速率是 从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
(10分)(1) 0.00045mol/(L.min) (2分)
(2)放热(2分) (3)78.26%(6分)
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.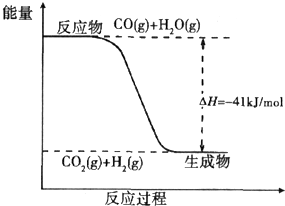 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.