题目内容
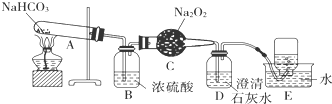
有一含NaCl、Na2CO3?10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
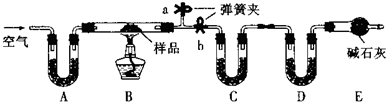
(1)点燃酒精灯之前,关闭b,打开a,缓缓通入空气数分钟,其目的是 .
(2)实验过程中,装置B中发生反应的化学方程式为 ;
(3)装置C、D中盛放的试剂分别为:C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(4)E装置中的仪器名称是 ,它在该实验中的主要作用是 ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数 .(填“偏大”、“偏小”或“无影响”)

(1)点燃酒精灯之前,关闭b,打开a,缓缓通入空气数分钟,其目的是
(2)实验过程中,装置B中发生反应的化学方程式为
(3)装置C、D中盛放的试剂分别为:C
(4)E装置中的仪器名称是
考点:探究物质的组成或测量物质的含量
专题:
分析:将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量.由C的增重(Na2CO3?10H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO3?10H2O的质量,从而求出NaCl的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,根据以上分析进行解答即可.
解答:
解:(1)本实验中需要分别测定反应生成的二氧化碳和水的质量,所以实验前必须将装置中的水蒸气和二氧化碳赶走,避免影响测定结果,故答案为:除去装置中的水蒸气和二氧化碳;
(2)加热时,碳酸氢钠分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑;十水碳酸钠分解生成碳酸钠和水,反应方程式为:Na2CO3?10H2O
Na2CO3+10H2O.故答案为:2NaHCO3
Na2CO3+H2O+CO2↑、Na2CO3?10H2O
Na2CO3+10H2O;
(3)装置C吸收Na2CO3?10H2O和NaHCO3分解生成的水蒸气,可以使用无水硫酸铜;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,故答案为:无水CaCl2;碱石灰;
(4)该仪器名称是(球形)干燥管;干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入影响测定结果,若撤去E装置,则测定的碳酸氢钠的质量偏大,碳酸氢钠分解生成水的质量偏高,而Na2CO3?10H2O的测定是根据生成水的总质量计算的,则测得Na2CO3?10H2O的含量将偏小,故答案为:故答案为:球形干燥管;防止空气中的CO2和水蒸气进入影响测定结果;偏小.
(2)加热时,碳酸氢钠分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3
| ||
| ||
| ||
| ||
(3)装置C吸收Na2CO3?10H2O和NaHCO3分解生成的水蒸气,可以使用无水硫酸铜;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,故答案为:无水CaCl2;碱石灰;
(4)该仪器名称是(球形)干燥管;干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入影响测定结果,若撤去E装置,则测定的碳酸氢钠的质量偏大,碳酸氢钠分解生成水的质量偏高,而Na2CO3?10H2O的测定是根据生成水的总质量计算的,则测得Na2CO3?10H2O的含量将偏小,故答案为:故答案为:球形干燥管;防止空气中的CO2和水蒸气进入影响测定结果;偏小.
点评:该本题综合考查元素化合物性质、测定混合物中各成分的质量分数,题目难度中等,解题时必须结合实验装置和物质的性质进行综合分析,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列离子在有关溶液中能大量共存的是( )
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应H2+I2?2HI,达到平衡时,生成HI 0.8mol,若其它条件不变,开始充入的H2为2mol,则达到平衡时生成的HI可能是下列中的( )
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |

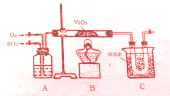 某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答: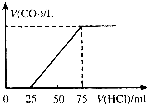 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.