题目内容
15.如图为元素周期表的一部分,请回答心里问题: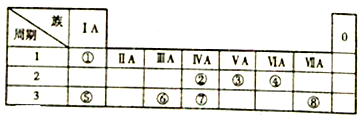
(1)若①和⑤可以形成原子个数比1:1的化合物,此时①显-1价.①和⑧形成的化合物的电子式为
 .
.(2)②和③的最高价含氧酸的酸性强弱顺序HNO3>H2CO3(填分子式).
(3)④和⑦形成的常见化合物的晶体类型为原子晶体,微粒间通过共价键形成了该晶体.
④和②形成的常见化合物的晶体类型为分子晶体,微粒间通过分子间作用力形成了该晶体.
(4)⑥为材料的容器可以装运浓硫酸或浓硝酸的理由是常温下Al遇浓硝酸或浓硫酸发生钝化.
分析 由元素在周期表的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)若①和⑤可以形成原子个数比1:1的化合物为NaH;①和⑧形成的化合物为HCl;
(2)同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
(3)④和⑦形成的常见化合物为SiO2;④和②形成的常见化合物为CO2;
(4)常温下Al遇浓硝酸或浓硫酸发生钝化.
解答 解:由元素在周期表的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)若①和⑤可以形成原子个数比1:1的化合物为NaH,Na为+1价,则此时①显-1价;①和⑧形成的化合物为HCl,其电子式为 ,
,
故答案为:-1; ;
;
(2)同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强,则②和③的最高价含氧酸的酸性强弱顺序为HNO3>H2CO3,
故答案为:HNO3;H2CO3;
(3)④和⑦形成的常见化合物为SiO2,晶体类型为原子晶体,微粒间通过共价键形成了该晶体;④和②形成的常见化合物为CO2,晶体类型为分子晶体,微粒间通过 分子间作用力形成了该晶体,
故答案为:原子晶体;共价键;分子晶体;分子间作用力;
(4)⑥为材料的容器可以装运浓硫酸或浓硝酸的理由是常温下Al遇浓硝酸或浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,
故答案为:常温下Al遇浓硝酸或浓硫酸发生钝化.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
5.已知常温下0.1mol•L-1NH4HCO3溶液的pH=7.8.溶液中含氮(或含碳)各微粒的分布分数(平衡时某种 微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )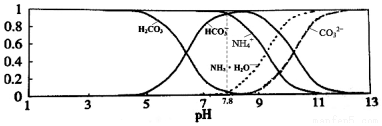

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
6.下列反应既属于非氧化还原反应,又属于吸热反应的是( )
| A. | 高温下炭与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 生石灰溶于水的反应 | D. | 盐酸与烧碱溶液的中和反应 |
3.下列有关有机物的说法正确的是( )
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 利用减压过滤的方法可以用来快速分离、提纯蛋白质 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
10.化学反应速率的大小主要取决于( )
| A. | 反应物的性质 | B. | 反应物的浓度 | C. | 反应的温度 | D. | 是否使用催化剂 |
20.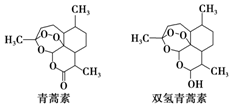 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| C. | 青蒿素有青蒿的芳香气味,是芳香族化合物 | |
| D. | 用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法 |
7.在一定温度下,下列叙述是可逆反应A(g)+3B(g)?2C(g)达平衡时的特征的是( )
(1)单位时间内生成a mol A,同时生成3a mol B;
(2)A、B、C的分子数之比为1:3:2;
(3)单位时间内消耗a mol A,同时生成3a mol B;
(4)A、B、C的浓度不再变化.
(1)单位时间内生成a mol A,同时生成3a mol B;
(2)A、B、C的分子数之比为1:3:2;
(3)单位时间内消耗a mol A,同时生成3a mol B;
(4)A、B、C的浓度不再变化.
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(3)(4) | D. | (1)(3) |
5.如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )


| A. | 该有机物的分子式为C3H6O3 | B. | 该有机物分子中含有羟基和羧基 | ||
| C. | 该有机物可以发生消去反应 | D. | 该有机物可以发生加成反应 |
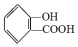 ,
,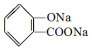 ;请写出将
;请写出将 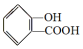 转化为
转化为 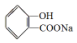 的化学方程式
的化学方程式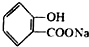 +H2O+CO2↑.
+H2O+CO2↑.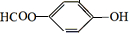
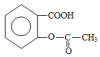 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是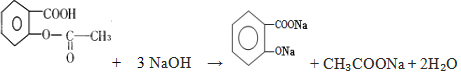 .
.