题目内容
5.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为$\frac{2(2b-a)}{V}$mol/L.分析 两等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),再利用电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$amol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2b-2×$\frac{1}{2}$amol=(2b-a)mol,
则原混合溶液中钾离子的浓度为$\frac{(2b-a)mol}{\frac{1}{2}V}$=$\frac{2(2b-a)}{V}$mol/L,
故答案为:$\frac{2(2b-a)}{V}$mol/L.
点评 本题考查离子反应的有关计算,为高频考点,根据电荷守恒计算钾离子的物质的量是关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
13.某元素原子最外层有2个电子,关于此元素的说法一定正确的是( )
| A. | ⅡA族元素 | |
| B. | 可能是金属元素,也可能是非金属元素 | |
| C. | 金属元素 | |
| D. | ⅡA族或ⅡB族元素 |
20.下列有关Na2CO3和NaHCO3的叙述错误的是( )
| A. | 水溶液都显碱性 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | NaHCO3比Na2CO3更易溶于水 | |
| D. | 与足量盐酸反应得到等量的CO2时,消耗NaHCO3的质量比Na2CO3的质量要少 |
10.精制蔗糖使之脱色,通常选用( )
| A. | SO2漂白 | B. | Cl2漂白 | C. | Na2O2漂白 | D. | 活性炭吸附 |
17.下列叙述正确的是( )
| A. | 500mL 0.5mol•L-1 K2SO4溶液中,K+的总数为NA | |
| B. | 2L 0.5mol•L-1 K2SO4溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O中含有10NA个质子 | |
| D. | 2L水中溶有80g的氢氧化钠,溶液的物质的量浓度为2mol•L-1 |
3.下列化学用语正确的是( )
| A. | CO2的结构式为O=C=O | B. | 乙烯的结构简式是C2H4 | ||
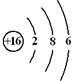
| C. | NaCl的电子式是Na:Cl: | D. | S原子的结构示意图: |
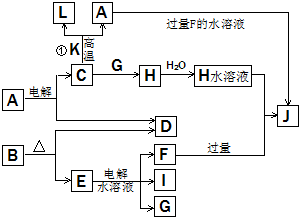 C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系: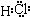 .
.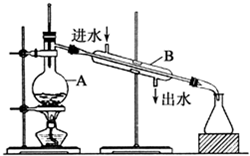
 ,电子式表示化合物 C2D 的形成过程
,电子式表示化合物 C2D 的形成过程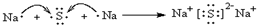 ;
;