题目内容
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ①③ 1/Vm mol/L 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 0.65 mol 0.4 mol
【解析】
(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,据此书写;
(2)根据生成物、实验现象以及氮元素化合价变化分析;
(3)根据反应的方程式以及c=n/V计算;
(4)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应;
(5)根据原子守恒和铜元素的化合价变化计算。
(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,因此反应开始的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)反应中有红棕色二氧化氮气体,溶液逐渐变蓝色,说明反应中氮元素化合价降低,铜元素化合价升高,因此体现浓硝酸的强氧化性,有硝酸铜生成,还体现硝酸的酸性,答案选①③;
(3)用V L的试管装满NO2气体,并倒扣在足量的水中发生反应:3NO2+H2O=2HNO3+NO,待试管中液面不再上升时溶液体积是2V/3 L,硝酸的物质的量是![]() ,因此试管中溶液的浓度为
,因此试管中溶液的浓度为 mol/L;
mol/L;
(4)加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)12.8gCu的物质的量为12.8g÷64g/mol=0.2mol,气体的物质的量为5.6L÷22.4L/mol=0.25mol,根据氮原子守恒可知参加反应的硝酸的物质的量为n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;铜元素化合价从0价升高到+2价失去2个电子,则反应中转移的电子的物质的量为0.2mol×2=0.4mol。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
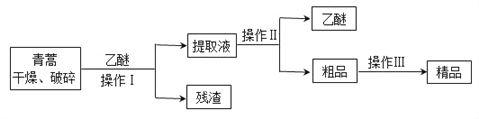
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是____________________。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、漏斗、_______,操作Ⅱ的名称是_______。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.20g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
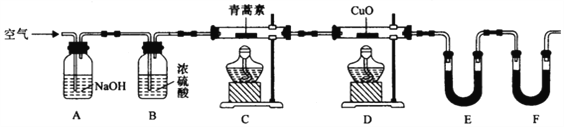
①装置E,F中盛放的物质分别是__________,____________。
②用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
③该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______。