题目内容
6.已知:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•mol-1.请回答下列问题:(1)对于气相反应,用某组分B的平衡分压p(B)代替平衡时物质B的物质的量浓度c(B)也可表示平衡常数,记作Kp,则该反应的平衡常数Kp$\frac{p({N}_{2})×{p}^{2}(C{O}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$.
(2)一定温度下,向密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol.
①若保持体积不变,再向容器中充入a mol NO,2b mol CO2,则此时v正<v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,t3时刻达到新的平衡状态.请在下图甲中补充画出t2-t3-t4时段N2物质的量的变化曲线.
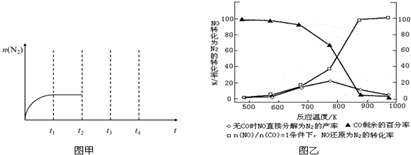
(3)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图乙所示.请判断若不使用CO,NO直接分解为N2的反应为放热反应(填“放热”或“吸热”).
(4)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
③2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-745.5kJ•mol-1
请写出表示C(s)的燃烧热的热化学方程式C(s)+O2(g)═CO2(g)△=-393KJ•mol-1.
分析 (1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比;
(2)①一定温度下,向密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
若保持体积不变,再向容器中充入a mol NO,2b mol CO2,二氧化碳浓度增大量大于NO浓度增大量,浓度商大于平衡常数,平衡逆向移动;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变;
(3)若不使用CO,温度超过775K左右,NO的分解率降低,说明升高温度平衡逆向移动;
(4)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
③2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-745.5kJ•mol-1
根据盖斯定律,(①+③+②)÷2可得:C(s)+O2(g)=CO2(g).
解答 解:(1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,故2NO(g)+2CO(g)?N2(g)+2CO2(g)用平衡分压表示的平衡常数Kp=$\frac{p({N}_{2})×{p}^{2}(C{O}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$,
故答案为:$\frac{p({N}_{2})×{p}^{2}(C{O}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$;
(2)①一定温度下,向密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
若保持体积不变,再向容器中充入a mol NO,2b mol CO2,二氧化碳浓度增大量大于NO浓度增大量,浓度商大于平衡常数,平衡逆向移动,v正<v逆,故答案为:<;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变,t2-t3-t4时段N2物质的量的变化曲线为: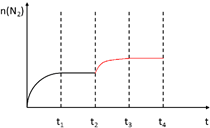 ,
,
故答案为: ;
;
(3)若不使用CO,温度超过775K左右,NO的分解率降低,说明升高温度平衡逆向移动,则正反应为放热反应,故答案为:放热反应;
(4)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
③2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-745.5kJ•mol-1
根据盖斯定律,(①+③+②)÷2可得:C(s)+O2(g)═CO2(g)△=-393KJ•mol-1,
故答案为:C(s)+O2(g)═CO2(g)△=-393KJ•mol-1.
点评 本题考查化学平衡计算与影响因素、平衡常数、盖斯定律应用等,(2)中①注意对平衡常数的理解与灵活应用,难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:2c(HCO3-)+2c (CO32-)+2c(H2CO3)=c(Na+) | |
| C. | 常温下,稀释0.1mol/L的氨水,溶液中所有离子浓度均下降 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |

(1)根据图2所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为BaSO4.图3表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是温度升高,Ni2+的水解程度增大.
(2)工艺流程中副产品的化学式为CuSO4•5H2O.
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F浓度为3×10-3mol•L-1,则Ca2+的浓度为3×10-6mol•L-1.(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH•H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
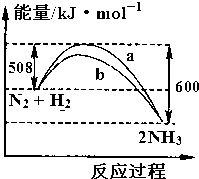
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 等物质的量的水与重水含有相同数目的中子数 | |
| C. | 氯分子的电子式: | |
| D. | 恒温恒容条件下HI分解成气态I2的反应,体系的总压强保持不变时,说明反应处于平衡态 |

 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应: