题目内容
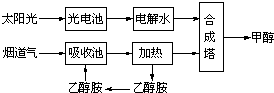
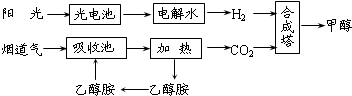
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
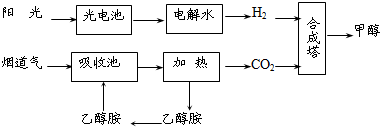
(1)该合成路线对于环境保护的价值在于 ;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因: ;
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: ;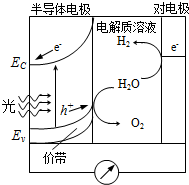
(4)科学家发明了一种基于如图所示原理的廉价光电化学电池装置,写出光照时半导体电极表面发生的电极反应式 .目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是 .
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存.

(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:

(4)科学家发明了一种基于如图所示原理的廉价光电化学电池装置,写出光照时半导体电极表面发生的电极反应式
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存.
分析:(1)根据二氧化碳造成的危害进行分析;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式;
(4)根据原电池工作原理,负极失去电子发生氧化反应写出电极反应式;根据单质硅的化学性质进行分析.
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式;
(4)根据原电池工作原理,负极失去电子发生氧化反应写出电极反应式;根据单质硅的化学性质进行分析.
解答:解:(1)二氧化碳会造成温室效应,而本题中的反应恰好消耗了二氧化碳,
故答案为:有利于防止温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-,
故答案为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
×②-①×
;所以△H=×
(-571.6kJ/mol)-(-1451kJ/mol)×
=-131.9kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9kJ/mol;
(4)原电池负极发生氧化反应,由图示可知,在负极水电离的氢氧根离子失去电子生成氧气和氢离子,电极反应式为:2H2O-4e-═O2↑+4H+;
a.硅在自然界主要以化合态存在,在自然界中存在大量的单质硅是错误的,故a错误;
b.通过化学变化可以获得大量单质硅,实现了硅的“再生”,故b正确;
c.硅是一种亲氧元素,自然界中总是与氧结合,燃烧放出的大量的热量,故c正确;
d.硅原子最外层4个电子,其化学性质不活泼,便于安全运输、贮存,故d正确;
故答案为:2H2O-4e-═O2↑+4H+;bcd.
故答案为:有利于防止温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-,
故答案为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9kJ/mol;
(4)原电池负极发生氧化反应,由图示可知,在负极水电离的氢氧根离子失去电子生成氧气和氢离子,电极反应式为:2H2O-4e-═O2↑+4H+;
a.硅在自然界主要以化合态存在,在自然界中存在大量的单质硅是错误的,故a错误;
b.通过化学变化可以获得大量单质硅,实现了硅的“再生”,故b正确;
c.硅是一种亲氧元素,自然界中总是与氧结合,燃烧放出的大量的热量,故c正确;
d.硅原子最外层4个电子,其化学性质不活泼,便于安全运输、贮存,故d正确;
故答案为:2H2O-4e-═O2↑+4H+;bcd.
点评:本题考查了盐类水解的应用、原电池工作原理等知识,题目难度中等,注意明确原电池工作原理、盐类水解的实质,试题提高了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
(14分)Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g)
+ 3H2O(g)
CH3OCH3(g)
+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
|
投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
(4)该反应的焓变△H 0,熵变△S___0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。