题目内容
16.将1mol I2(g)和2mol H2(g)置于某2L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)$\stackrel{△}{?}$2HI(g),2min时,测得I2的物质的量为0.6mol,10min后达到平衡.此过程中,HI的体积分数φ(HI)随时间的变化如图中曲线Ⅱ所示: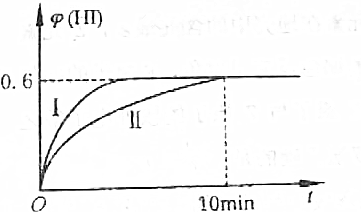
请回答下列问题:
(1)前2min内,用HI表示的平均反应速率为0.2mol•L-1•min-1.
(2)达到平衡时,I2(g)的物质的量浓度为0.05mol•L-1.
(3)若起始时容器的容积为1L,φ(HI)的变化如图曲线Ⅰ所示,则平衡时HI(g)的物质的量浓度为1.8mol•L-1.
分析 (1)根据2min时,测得I2的物质的量为0.6mol结合V=$\frac{△c}{△t}$计算碘的反应速率,再根据反应速率之比等于系数之比计算H2的平均反应速率;
(2)根据原子守恒计算碘的物质的量浓度;
(3)根据三行式计算各物质的平衡浓度.
解答 解:(1)2min时,测得I2的物质的量为0.6mol,则V(I2)=V(H2)=$\frac{△c}{△t}$=$\frac{\frac{1-0.6}{2}}{2}$mol•L-1•min-1=0.1 mol•L-1•min-1,用HI表示的平均反应速率为碘单质表示的速率的2倍,即0.2 mol•L-1•min-1,故答案为:0.2;
(2)碘的初始浓度=0.5mol/L,该反应前后气体体积不变,平衡时,HI的体积分数为0.6,则n(HI)=3mol×0.6=1.8mol,C(HI)=0.9mol/L,根据I原子守恒得C(HI)+2C(I2)=0.5mol/L×2,C(I2)=$\frac{1-0.9}{2}$mol/L=0.05mol•L-1,故答案为:0.05;
(3)达到平衡时,HI的体积分数为0.6,设碘化氢的浓度是x,
I2(g)+H2(g)$\stackrel{△}{?}$2HI(g),
初始浓度:1 2 0
变化浓度:0.5x 0.5x x
平衡浓度:1-0.5x 2-0.5x x
$\frac{x}{1-0.5x+2-0.5x+x}$×100%=60%,解得x=1.8,则平衡时HI(g)的物质的量浓度是1.8mol/L.故答案为:1.8.
点评 本题考查了反应速率的计算以及物质的量浓度计算等知识点,根据图象中反应时间、HI的体积分数确定结合三行式计算是重点,难度中等.

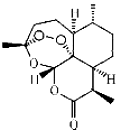 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )| A. | 青蒿素是无机物 | |
| B. | 青蒿索的摩尔质量为282 | |
| C. | 屠呦呦发现用乙醚提取青蒿素效果很好,表明青蒿素难溶于水,易溶于乙醚,在水中溶解度不大 | |
| D. | 屠呦呦获得的是诺贝尔生理学或医学奖,说明无需学好化学,也能在医学上取得非凡的成绩 |
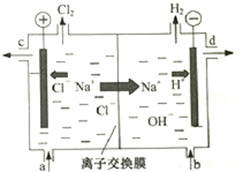 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)精制饱和食盐水从图中a位置补充,氢氧化钠溶液从图中d位置流出.(选填“a”、“b”、“c”或“d”)
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质.写出该反应的化学方程式2KClO3+H2C2O4+2H2SO4=2ClO2+2CO2+2KHSO4+2H2O.
(4)已知室温下几种弱酸的平衡常数:
| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
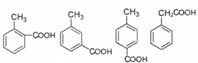
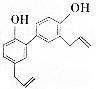 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.下列有关该物质的叙述正确的是( )
| A. | 1个厚朴酚分子中含有16个碳原子 | |
| B. | 厚朴酚能使酸性KMnO4溶液褪色,遇FeCl3溶液显色 | |
| C. | 1mol厚朴酚与足量NaHCO3溶液反应放出22.4LCO2(标准状况) | |
| D. | 1mol厚朴酚能与4molBr2(Br2的CCl4溶液)反应 |
| A. | 金属锗是一种良好的导热、导电材料 | |
| B. | 元素的非金属性越强,其氢化物的沸点越高 | |
| C. | 同周期相邻主族元素的原子,其质子数之差均为1 | |
| D. | 最外层电子数为4的原子,其元素一定处于ⅣA族 |
| A. | 塑料、人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-═CO2↑+H2O+NH3↑ |
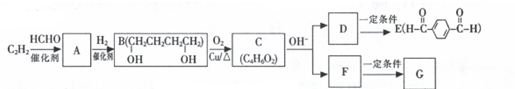

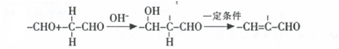
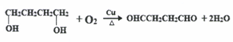 .
. (任意一种)(任写一种).
(任意一种)(任写一种). $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$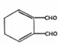 +H2O.
+H2O.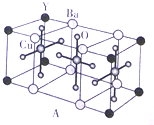 NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题:
NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题: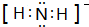 其中心原子的杂化类型是sp3
其中心原子的杂化类型是sp3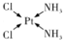 .
.