题目内容
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2???????????????????? ???? B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应?? ????? D.X中不能确定的离子是 A13+和C1―
D
【解析】
试题分析:pH=1的X溶液显酸性,在此溶液中因为发生反应:CO32-+2H+=CO2↑+H2O,及SO32-+2H+ = SO2↑+H2O不可能存在CO32-和SO32-。向该溶液中加入过量的Ba(NO3)2溶液,产生气体A、溶液B和沉淀C。则沉淀为BaSO4。原溶液中含有SO42-.由于HNO3有强的氧化性,产生气体则说明含有还原性的离子,与HNO3反应,硝酸被还原为NO气体。原溶液中含有Fe2+,气体A为NO,2NO+O2=2NO2.气体B为NO2。3NO2+H2O=2HNO3+ NO.溶液E为HNO3。由于开始加入的Ba(NO3)2溶液是过量的。所以溶液B中一定含有Ba(NO3)2。向溶液B中加入足量的NaOH溶液,产生气体F,则F为NH3,原溶液中含有NH4+。溶液H和沉淀G,由于原溶液中含有Fe2+,它在酸性条件下被硝酸氧化为Fe3+.这时发生反应:Fe3++3OH-=Fe(OH)3↓.由于开始加入的Ba(NO3)2溶液及后来加入的NaOH溶液都是过量的。所以在溶液H中一定含有Ba(NO3)2、NaOH。当向其中通入过量的CO2气体时,发生反应CO2+2NaOH=Na2CO3+H2O; Na2CO3+Ba(NO3)2= BaCO3↓+2NaNO3.沉淀I中一定含有BaCO3。根据上述分析可知:原溶液一定含有的离子为:Fe2+、NH4+、SO42―;一定不含有的离子是CO32―、SO32―;不能确定是否存在的离子是C1―、A13+。因此正确选项为D。
考点:考查离子的鉴定的知识。




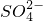 离子,加入下列沉淀剂的顺序是(填序号)______.
离子,加入下列沉淀剂的顺序是(填序号)______.