题目内容
15.两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=NO+SO3,在体积为V L的密闭容器中通入a molNO2和bmolSO2,反应后容器内硫原子和氧原子个数比为( )| A. | $\frac{3}{10}$ | B. | $\frac{b}{2a+2b}$ | C. | $\frac{3}{16}$ | D. | $\frac{5}{16}$ |
分析 由NO2+SO2=NO+SO3及质量守恒定律可知,反应前后S、O原子个数不变,以此计算.
解答 解:由NO2+SO2=NO+SO3及质量守恒定律可知,反应前后S、O原子个数不变,反应前通入a molNO2和bmolSO2,原子个数比等于物质的量比,则反应后容器内硫原子和氧原子个数比为$\frac{bmol}{2amol+2bmol}$=$\frac{b}{2a+2b}$,
故选B.
点评 本题考查化学方程式的计算,为高频考点,把握发生的反应、质量守恒定律为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
5.我国卫星发射所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O.有的国家用肼(N2H4)作为火箭发动机的燃料.NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1.
下列关于肼和NO2反应的热化学方程式中正确的是( )
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1.
下列关于肼和NO2反应的热化学方程式中正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=1 135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1 135.7 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=1 135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1 135.7 kJ•mol-1 |
6.下列说法正确的是( )
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 往BaCl2溶液中通入少量CO2有白色沉淀生成 | |
| C. | 医用酒精、冰醋酸、液态HCl都是混合物 | |
| D. | 乙酸乙酯和一氯乙烷在一定条件下均可水解生成乙醇 |
3.在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
| a(干燥气体) | b(液体) | 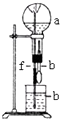 | |
| A | Cl2 | 饱和食盐水 | |
| B | NO+O2(物质的量之比为4:1) | H2O | |
| C | CO2 | NaOH | |
| D | NO2 | H2O |
| A. | A | B. | B | C. | C | D. | D |
10.对于有单质和化合物生成的反应,下列说法中正确的是( )
| A. | 不可能是分解反应 | B. | 一定是置换反应 | ||
| C. | 可能是化合反应 | D. | 一定不是复分解反应 |
20.下列事实不能用元素周期律解释的只有( )
| A. | 碱性:KOH>NaOH | B. | 酸性:HClO4>H2SO4 | ||
| C. | 相对原子质量:Ar>K | D. | 元素的金属性:Mg>Al |



