题目内容
11.设阿伏加德罗常数的值为NA,下列说法正确的是( )| A. | 0℃,1.01×105Pa时,22.4L空气中所含的N2、O2分子总数为5NA | |
| B. | 100mL 0.1mol/L的硝酸钙溶液中钙离子的数目为0.02NA | |
| C. | 6.5g Zn由原子变为离子时失去的电子数目为0.2NA | |
| D. | 0.012kg的${\;}_{6}^{14}$C中的碳原子数目等于NA |
分析 A、0℃,1.01×105Pa即为标况,气体摩尔体积为22.4L/mol,根据分子个数N=$\frac{V}{Vm}{N}_{A}$来计算;
B、求出硝酸钙的物质的量,然后根据1mol硝酸钙中含1mol钙离子来分析;
C、求出锌的物质的量,然后根据锌反应后变为+2价来分析;
D、${\;}_{6}^{14}$C由碳原子构成,且原子个数N=$\frac{m}{M}{N}_{A}$.
解答 解:A、0℃,1.01×105Pa即为标况,气体摩尔体积为22.4L/mol,故分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA,故A错误;
B、溶液中硝酸钙的物质的量n=CV=0.1mol/L×0.1L=0.01mol,而1mol硝酸钙中含1mol钙离子,故0.01mol硝酸钙中含0.01NA个钙离子,故B错误;
C、6.5g锌的物质的量为0.1mol,而锌反应后变为+2价,故0.1mol锌反应失去0.2NA个电子,故C正确;
D、${\;}_{6}^{14}$C由碳原子构成,且${\;}_{6}^{14}$C原子个数N=$\frac{m}{M}{N}_{A}$=$\frac{12g}{14g/mol}×{N}_{A}/mol$=$\frac{6}{7}{N}_{A}$,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列关于煤及其综合利用的说法中正确的是( )
| A. | 煤的主要成分是单质碳 | |
| B. | 煤的干馏是指将煤在空气中加强热使之分解的过程 | |
| C. | 煤通过干馏得到的苯和甲苯属于同系物 | |
| D. | 煤气化的目的主要是获得甲烷,煤液化的目的主要是获得苯 |
6.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连成原电池.若b、d相连时,d为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,则四种金属的活动性顺序由强到弱为( )
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
16.某气体能使湿润的红色石蕊试纸变蓝,则该气体是( )
| A. | NO | B. | NH3 | C. | Cl2 |
20.下列叙述正确的是( )
| A. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 间二溴苯仅有一种空间结构的事实可证明苯分子中不存在单双键交替的结构 | |
| D. | (CH3)2C=CHCH2CH3分子中的6个碳原子中至少有5个在同一个平面上 |
1.下列关于检验有机物中官能团的方法正确的是( )
| A. | 若样品为水溶液且只取一次有机物,检验 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 中官能团,应该先向其中加入 三氯化铁溶液检验酚羟基;再加入足量氢氧化钠溶液,加热,用稀硝酸酸化后,最后加入 硝酸银溶液检验氯原子 | |
| B. | 只检验 CH2=CH-CHO 中的碳碳双键不能用溴水,但是可以用溴的四氯化碳溶液 | |
| C. | 若样品为水溶液且只取一次有机物,检验 ClCH2COOH 中官能团,应该先加入足量氢 氧化钠溶液,加热,再用足量稀硝酸酸化后,加入硝酸银溶液检验氯原子;最后加入碳酸 氢钠溶液检验羧基 | |
| D. | 若样品为水溶液且只取一次有机物,检验邻羟基苯甲醇中的官能团,应该先加入紫色 石蕊试液检验酚羟基;再加入金属钠检验醇羟基 |

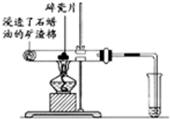 (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: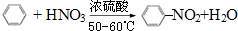 .
.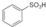 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.