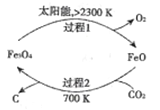
��Ŀ����
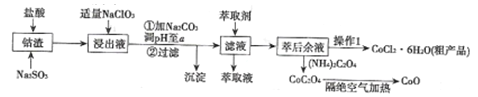
����Ŀ����������[��Co(OH)2��Fe2O3��Al2O3��MnO��)��������ȡ����������CoCl2��6H2O������������ͼ��ʾ��
������������������������ʽ����ʱ��Һ��pH���±�������������Ũ��Ϊ��0.01mol/L)
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��CoCl2��6H2O�۵�Ϊ86�棬������110��120��ʱ��ʧȥ�ᾧˮ������ˮ�Ȼ��ܡ�
�ش��������⣺
��1������Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��A13+�ȣ�����������Co(OH)3������Ӧ�����ӷ���ʽΪ________��
��2�������м���������NaClO3��������___________��������NaClO3���������ܲ����ж����壬д�����ɸ��ж���������ӷ���ʽ___________________��
��3������Na2CO3������Һ��pH=a,a�ķ�Χ�����___________����������Ҫ�ɷ���______��
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ��������Һ���м�����ȡ����Ŀ����________����ʹ�õ����pH��Χ��________��
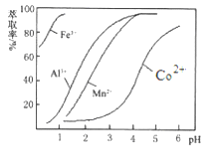
A. 2.0��2.5 B. 3.0��3.5 C. 4.0��4.5 D. 5.0��5.5
��5��������1���а���3������ʵ�����������������______��______���ˡ�
��6��������������CoC2O4����CoO��̼���������Ӧ�Ļ�ѧ����ʽΪ_______________��
���𰸡� 2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O ��Fe2+����ΪFe3+ ClO3-+5Cl-+6H+=3Cl2��+3H2O 5.2��7.6 Fe(OH)3��Al(OH)3 ��Mn2+��ȥ B ����Ũ�� ��ȴ�ᾧ CoC2O4![]() CoO+CO+CO2��
CoO+CO+CO2��
��������(1)����Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��A13+�ȣ�˵������������Co(OH)3��������������SO32-����������ԭ��Ӧ����������ӷ���ʽΪ2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O��
(2)����������NaClO3�ɽ�Fe2+����ΪFe3+��������ͨ��������ҺpH��ȥ��������Fe3+��������NaClO3�����������������£���������Һ���Cl-�������ж�����Cl2��������Ӧ�����ӷ���ʽΪClO3-+5Cl-+6H+=3Cl2��+3H2O��
(3)����Na2CO3������Һ��pH=a��Ŀ����ʹFe3+��A13+������ȫ����Co2+����������ϲ���������������������ʽ����ʱ��Һ��pH��Χ��֪��a�ķ�Χ�����5.2��7.6�����۳�������Ҫ�ɷ���Fe(OH)3��Al(OH)3��
(4)������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�������Һ���м�����ȡ����Ŀ���ǽ�Mn2+��ȥ������ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺPH��3.0��3.5֮�䣬��ʹMn2+��ȫ����������ֹCo2+ת��ΪCo(OH)2�������ʴ�ΪB��
(5)���ô���Һ����ȡ����ķ�����ȡ�Ȼ��ܹ��壬�����1����Ϊ������Ũ������ȴ�ᾧ���ˣ�
(6)������������CoC2O4����CoO��̼��������������ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪCoC2O4![]() CoO+CO+CO2����
CoO+CO+CO2����