题目内容
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域.除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气.
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;
A.加入C(s)B.加入H2O(g)C.升高温度D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+
O2(g)?CO(g)+2H2O(g)△H=-519kJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)?CH3OHg);△H=-90.8kJ?mol-1,T℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如表:
①该时间段内反应速率v(H2)= mol-1?L-1?min-1.
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是 .
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
| ||
①此反应的化学平衡常数表达式为
②下列能增大碳的转化率的措施是
A.加入C(s)B.加入H2O(g)C.升高温度D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+
| 3 |
| 2 |
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)?CH3OHg);△H=-90.8kJ?mol-1,T℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如表:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
②比较此时正、逆反应速率的大小:v正
(4)生产过程中,合成气要进行循环,其目的是
考点:化学平衡的影响因素,反应速率的定量表示方法,化学平衡常数的含义,化学反应速率的影响因素
专题:化学平衡专题,化学反应速率专题
分析:(1)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②增大碳的转化率,应采取措施使平衡向正反应移动,结合外界条件对平衡移动影响分析;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;
(3)①根据甲醇的浓度计算氢气的浓度变化量,再根据v=
计算v(H2);
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
③合成气进行循环,可以提高原料利用率.
②增大碳的转化率,应采取措施使平衡向正反应移动,结合外界条件对平衡移动影响分析;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;
(3)①根据甲醇的浓度计算氢气的浓度变化量,再根据v=
| △c |
| △t |
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
③合成气进行循环,可以提高原料利用率.
解答:
解:(1)①C(s)+H2O(g)
CO(g)+H2(g)的平衡常数K=
,故答案为:
;
②A.加入固体C(s),不影响平衡移动,故A错误;
B.加入H2O(g),水蒸气的浓度增大,平衡向正反应方向移动,碳的转化率增大,故B正确;
C.正反应是吸热反应,升高温度平衡向正反应方向移动,碳的转化率增大,故C正确;
D.增大压强,平衡向逆反应方向移动,碳的转化率降低,故D错误;
故答案为:BC;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低;
(3)①由表中数据可知,l0min内甲醇的浓度变化量为0.4mol/L,故氢气的浓度变化量为0.4mol/L×2=0.8mol/L,故v(H2)=
=0.08mol/(L?min),
故答案为:0.08;
②由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).
| ||
| c(CO)?c(H2) |
| c(H2O) |
| c(CO)?c(H2) |
| c(H2O) |
②A.加入固体C(s),不影响平衡移动,故A错误;
B.加入H2O(g),水蒸气的浓度增大,平衡向正反应方向移动,碳的转化率增大,故B正确;
C.正反应是吸热反应,升高温度平衡向正反应方向移动,碳的转化率增大,故C正确;
D.增大压强,平衡向逆反应方向移动,碳的转化率降低,故D错误;
故答案为:BC;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低;
(3)①由表中数据可知,l0min内甲醇的浓度变化量为0.4mol/L,故氢气的浓度变化量为0.4mol/L×2=0.8mol/L,故v(H2)=
| 0.8mol/L |
| 10min |
故答案为:0.08;
②由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
| 0.4 |
| 0.22×0.1 |
③生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).
点评:本题考查化学平衡常数、化学平衡影响因素、反应速率计算、反应中能量变化等,难度中等,注意理解掌握平衡常数的用途.

练习册系列答案
相关题目
新能源的特点是资源丰富,无污染或很少污染,且可以再生.下列属于新能源的是( )
| A、太阳能 | B、石油 | C、天然气 | D、煤 |
下列有机物的命名正确的是( )
A、 :2,2,4三甲基戊烷 :2,2,4三甲基戊烷 |
| B、CH3CHO:甲酸 |
C、 :2乙基3丁烯 :2乙基3丁烯 |
D、 :2-羟基丁烷 :2-羟基丁烷 |
下列物质既能发生消去反应,又能氧化成醛的是( )
| A、CH3CHOHCH3 |
B、 |
C、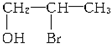 |
D、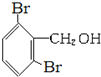 |