题目内容
根据右图,可判断出下列离子方程式中错误的是
A.![]()
B.![]()
C.![]()
D.![]()
A
解析:本题主要结合原电池装置考查离子方程式的书写。根据图中电极标有“+”和“—”,可确定分别为正极和负极,且金属做电极,故负极金属活动性强于正极金属,结合原电池装置可判断金属性分别为Cd>Co和Co>Ag,即Cd>Co>Ag。由于金属性Cd强于Ag,即A项反应不可能发生;根据金属活动性,可知后三个离子反应均能自发进行。
误区警示:同样的装置,若有外接电源,则为电解池,否则就是原电池。原电池负极和正极分别发生氧化反应和还原反应,一般说来,负极金属性要强于正极金属性。但在Mg-Al-NaOH溶液构成的电池中,由于Mg不能和NaOH溶液反应,且Al能和NaOH溶液反应,即Al和Mg分别做负极和正极。

(15分)
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
|
元素 |
性质或结构信息 |
|
X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
|
Y |
二价阳离子的外围电子层排布为3d9 |
|
T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
|
Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。

⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
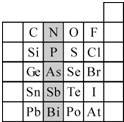
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分. 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)