题目内容
在一定温度下,将气体X和Y各1.600mol充入10L恒容密闭容器中,发生如下反应:X(g)+Y(g)?2Z(g)△H.在反应过程中,X的物质的量与时间的关系如表所示:
请回答下列问题:
(1)达到平衡后,升高温度,
减少,则△H 0(填“>”“<”或“=”)
(2)欲提高Y的反应速率,宜采用的措施有 (填两条即可).
(3)4-6min内Z的平均反应速率为 上述可逆反应的平衡常数K=
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol.达到平衡时Z的体积分数 (填“增大”“减少”或“不变”,下同)X的转化率将 .
| L/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
(1)达到平衡后,升高温度,
| c2(Z) |
| c(X)?c(Y) |
(2)欲提高Y的反应速率,宜采用的措施有
(3)4-6min内Z的平均反应速率为
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol.达到平衡时Z的体积分数
考点:化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)升温
减少,则平衡逆向进行,正反应为放热反应;
(2)根据影响化学反应速率的因素回答;
(3)依据图表数据结合反应速率概念计算,V=
计算得到;计算X的反应速率,结合反应速率之比等于化学方程式计量数之比计算Z的反应速率;
依据化学平衡三段式列式计算,平衡常数=
;
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol,等效于在此平衡的基础上再加入1.6mol Z,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变,但平衡时X的量增加,则X的转化率减小.
| c2(Z) |
| c(X)?c(Y) |
(2)根据影响化学反应速率的因素回答;
(3)依据图表数据结合反应速率概念计算,V=
| △c |
| △t |
依据化学平衡三段式列式计算,平衡常数=
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol,等效于在此平衡的基础上再加入1.6mol Z,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变,但平衡时X的量增加,则X的转化率减小.
解答:
解:(1)升温
减少,则平衡逆向进行,正反应为放热反应,△H<0,故答案为:<;
(2)根据影响化学反应速率的因素,则欲提高Y的反应速率,宜采用的措施有升温,增加压强等,故答案为:升温,增加压强;
(3)依据图表数据结合反应速率概念计算,V(X)=
=
=0.00125mol/(L?min),V(Z)=2V(X)=2×0.00125mol/(L?min)=0.0025mol/(L?min),则
X(g)+Y(g)?2Z
起始量(mol/L) 0.16 0.16 0
变化量(mol/L) 0.06 0.06 0.12
平衡量(mol/L) 0.1 0.1 0.12
平衡常数=
=
=1.44,故答案为:0.0025mol/L;1.44;
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol,等效于在此平衡的基础上再加入1.6mol Z,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变,但平衡时X的量增加,则X的转化率减小,故答案为:不变;减小.
| c2(Z) |
| c(X)?c(Y) |
(2)根据影响化学反应速率的因素,则欲提高Y的反应速率,宜采用的措施有升温,增加压强等,故答案为:升温,增加压强;
(3)依据图表数据结合反应速率概念计算,V(X)=
| △c |
| △t |
| (1.100-1.075)mol |
| 10L×(6-4)min |
X(g)+Y(g)?2Z
起始量(mol/L) 0.16 0.16 0
变化量(mol/L) 0.06 0.06 0.12
平衡量(mol/L) 0.1 0.1 0.12
平衡常数=
| 生成物平衡你的幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.12 2 |
| 0.1×0.1 |
(4)若保持其他条件不变,起始时间充入X、Y、Z的物质的量均为1.6mol,等效于在此平衡的基础上再加入1.6mol Z,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变,但平衡时X的量增加,则X的转化率减小,故答案为:不变;减小.
点评:本题考查了化学平衡影响因素分析判断,平衡常数计算应用,掌握基础是解题关键,注意影响因素的理解应用,题目难度中等.

练习册系列答案
相关题目
下列反应中,属于加成反应的是( )
| A、CH3Cl+Cl2→CH2Cl2+HCl |
| B、CH3-CH=CH2+Br2─→CH3-CHBr-CH2Br |
C、 |
D、 |
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-2b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
| A、能与水反应 |
| B、能与氢氧化钠溶液反应 |
| C、能与硫酸反应 |
| D、能与碳酸钠溶液反应 |
四种短周期元素W、X、Y、Z原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法正确的是( )
| A、与W相邻的同主族元素单质的重要用途是制作光纤 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、由非金属性强弱可知,不可能由W的含氧酸制备Z的含氧酸 |
 ,试回答:
,试回答: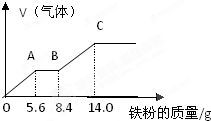 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
