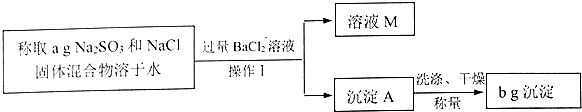
题目内容
16.135g的ClO2中有4mol氧原子,有NA个氯原子,有66NA个质子.分析 二氧化氯的相对分子质量为:35.5+16×2=67.5,根据n=$\frac{m}{M}$计算出135g ClO2的物质的量,然后分别计算出含有的氧原子、氯原子、质子的物质的量,再根据N=nNA计算出含有的氯原子、质子数.
解答 解:135g的ClO2的物质的量为:n(ClO2)=$\frac{135g}{67.5g/mol}$=2mol,2mol ClO2中含有O的物质的量为:n(O)=2n(ClO2)=2mol×2=4mol;
含有Cl原子的物质的量为:n(Cl)=n(ClO2)=2mol,含有氯原子的数目为:N(Cl)=nNA=NA;
ClO2中含有的质子数为:17+8×2=33,2mol ClO2中含有质子的物质的量为:2mol×33=66mol,含有质子的数目=nNA=66NA,
故答案为:4;NA;66NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(SO32-)=0.5 mol•L-1的溶液中:ClO-、Na+、Cl-、CO32- | |
| B. | pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ | |
| C. | 强碱性溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 水电离产生的c(H+)=1×10-14mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
7.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将少量某物质的溶液滴加到新制氢氧化铜中,加热 | 有红色沉淀生成 | 该物质一定属于醛类 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度小于Mg(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
4.X、Y、Z是3种短周期元素,其中X、Z位于同一主族.X原子的最外层电子数是其电子层数的3倍.X原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
3.已知碳碳单键可以绕键轴自由旋转,对结构简式为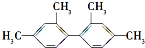 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃的苯环上的一氯代物有5种 |
7.下列除去杂质所选用的试剂正确的是( )
| A. | 除去N2中混有的O2:选用灼热的铜网 | |
| B. | 除去CO2中混有的CO:选用澄清石灰水 | |
| C. | 除去BaCO3固体中混有的BaSO4:选用稀硫酸 | |
| D. | 除去Fe粉中混有的Cu粉:选用稀盐酸 |
8.图中每条折线表示周期表IVA~VIIA中的某一族元素氢化物的沸点变化,其中a点代表的是( )


| A. | SiH4 | B. | HCl | C. | PH3 | D. | H2S |