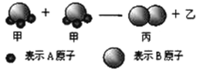
题目内容
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其结构如图所示,其中碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属______分子(选填“极性”“非极性”),其分子的空间构型为_____。新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。金属Cu为________堆积,配位数为_______。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的配合物,可溶于多数有机溶剂。该晶体属于______晶体,三种元素电负性由大到小的顺序为(填元素符号)_____。配体CO的任意一种等电子体的电子式:_____。配体CO中与Co形成配位键的原子是C而不是O的原因是________。
【答案】3 sp2和sp3 极性 平面三角形 乙酸分子间形成氢键,作用力大,熔沸点高 16 面心立方最密堆积 12 分子 O>C>Co ![]() C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
【解析】
(1)Co元素是27号元素,核外电子排布式为:[Ar]3d74s2;碳原子形成3个C-C键,没有孤电子对,杂化轨道为3,还有饱和C原子,形成3个C-H键和一个C-C键;
(2)甲醛分子中C原子形成3个σ键,没有孤电子对,价层电子对数=3+0=3,据此判断空间构型,正负电荷重心重合属于非极性分子,否则属于极性分子;乙酸分子间会形成氢键,增加了分子之间的吸引力;先用均摊方法计算晶胞中含有的O原子数,然后根据化学式确定其中含有的Cu原子数目;金属Cu为面心立方最密堆积,配位数是12;
(3)熔点低,溶于有机溶剂,符合分子晶体的性质;同周期主族元素自左而右电负性增大,一般非金属性越强电负性越大;CO与氮气分子互为等电子体,C、O均有孤对电子,电负性越大越不易给出电子。
(1)Co元素是27号元素,核外电子排布式为:[Ar]3d74s2,3d上有3个成对电子;根据单壁碳纳米管结构可知:碳原子形成3个C-C键,没有孤电子对,杂化轨道为3,碳原子杂化方式为:sp2;除此之外还有饱和C原子,其杂化方式为sp3杂化;
(2)甲醛分子中C原子形成3个σ键,没有孤电子对,价层电子对数=3+0=3,空间构型为平面三角形,正负电荷重心不重合,属于极性分子;新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,主要原因是乙酸分子间形成氢键,使分子之间的作用力增大,导致克服分子间作用力使物质熔化、气化消耗的能量多,因此物质的熔沸点高。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中含义的O原子数为8×![]() +6×
+6×![]() +4=8,由于Cu2O中Cu:O=2:1,所以该晶胞中含有的Cu原子数目为2×8=16;金属Cu为面心立方最密堆积堆积,配位数为
+4=8,由于Cu2O中Cu:O=2:1,所以该晶胞中含有的Cu原子数目为2×8=16;金属Cu为面心立方最密堆积堆积,配位数为![]() =12。
=12。
(3)羰基钴熔点低,溶于有机溶剂,属于分子晶体;同一周期的主族元素自左而右电负性增大,一般非金属性越强电负性越大,所以元素的电负性:O>C>Co;CO与N2分子互为等电子体,N2的电子式为![]() ;CO中C、O原子均有孤对电子,C原子半径比O大,电负性小,对孤对电子吸引较弱,更容易形成配位键。
;CO中C、O原子均有孤对电子,C原子半径比O大,电负性小,对孤对电子吸引较弱,更容易形成配位键。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。