题目内容
25℃时,氢硫酸(H2S)饱和溶液的浓度为0.1mol?L-1,写出氢硫酸在溶液中的电离方程式
(1)向A溶液中加入等体积的CuSO4溶液,恰好完全反应,反应的离子方程式为
(2)向B溶液中加入适量的碘水,恰好完全反应,反应的离子方程式为
(3)向C溶液中加入少量Na2S晶体,振荡后溶液的pH将
H2S?HS-+H+、HS-?S2-+H+
H2S?HS-+H+、HS-?S2-+H+
.若此时溶液的pH=4,向该溶液中滴入甲基橙试液,溶液显橙
橙
色.将变色后的溶液分成A、B、C三份,分别进行下列实验:(1)向A溶液中加入等体积的CuSO4溶液,恰好完全反应,反应的离子方程式为
H2S+Cu2+=2H++CuS↓
H2S+Cu2+=2H++CuS↓
,静置后的澄清的溶液呈红
红
无此空
无此空
色;(2)向B溶液中加入适量的碘水,恰好完全反应,反应的离子方程式为
H2S+I2=2H++2I-+S↓
H2S+I2=2H++2I-+S↓
,假设溶液的体积增大一倍,此时溶液的pH约为1
1
;(3)向C溶液中加入少量Na2S晶体,振荡后溶液的pH将
增大
增大
(填“增大”、“减小”或“不变”).分析:硫化氢是二元弱酸,在水溶液里分步电离,甲基橙的变色范围是3.1-4.4,若溶液的pH=4,则向溶液中加入甲基橙,溶液呈橙色,
(1)硫化氢和硫酸铜反应生成硫化铜黑色沉淀,同时生成硫酸,溶液的酸性增强,根据溶液pH大小确定溶液颜色;
(2)碘和硫化氢反应生成硫单质和氢碘酸,根据氢离子浓度计算溶液的pH;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离.
(1)硫化氢和硫酸铜反应生成硫化铜黑色沉淀,同时生成硫酸,溶液的酸性增强,根据溶液pH大小确定溶液颜色;
(2)碘和硫化氢反应生成硫单质和氢碘酸,根据氢离子浓度计算溶液的pH;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离.
解答:解:硫化氢是二元弱酸,在水溶液里分步电离,第一步电离方程式为:H2S?HS-+H+,第二步电离方程式为:HS-?S2-+H+,甲基橙的变色范围是3.1-4.4,若溶液的pH=4,则向溶液中加入甲基橙,溶液呈橙色,
故答案为:H2S?HS-+H+、HS-?S2-+H+;橙;
(1)硫化氢和硫酸铜反应生成硫酸和硫化铜黑色沉淀,离子反应方程式为:H2S+Cu2+=2H++CuS↓,溶液由弱酸变成强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,加入甲基橙后溶液呈红色,故答案为:H2S+Cu2+=2H++CuS↓;红;
(2)碘和硫化氢反应生成硫单质和氢碘酸,离子反应方程式为:H2S+I2=2H++2I-+S↓,氢碘酸是强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,故答案为:H2S+I2=2H++2I-+S↓;1;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离,导致溶液中氢离子浓度减小,所以pH增大,故答案为:增大.
故答案为:H2S?HS-+H+、HS-?S2-+H+;橙;
(1)硫化氢和硫酸铜反应生成硫酸和硫化铜黑色沉淀,离子反应方程式为:H2S+Cu2+=2H++CuS↓,溶液由弱酸变成强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,加入甲基橙后溶液呈红色,故答案为:H2S+Cu2+=2H++CuS↓;红;
(2)碘和硫化氢反应生成硫单质和氢碘酸,离子反应方程式为:H2S+I2=2H++2I-+S↓,氢碘酸是强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,故答案为:H2S+I2=2H++2I-+S↓;1;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离,导致溶液中氢离子浓度减小,所以pH增大,故答案为:增大.
点评:本题考查弱电解质电离,明确物质间的反应是解本题关键,注意氢碘酸是强酸,其酸性比盐酸强,且是强还原性酸.

练习册系列答案
相关题目
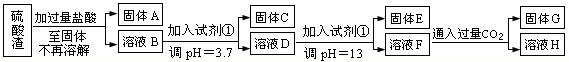
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10-12)