题目内容
6.50mL 0.1mol/L BaCl2与100mL 0.75mol/L H2SO4溶液混合,求:(1)产生沉淀多少克?
(2)反应后溶液的pH为多少.
分析 (1)氯化钡和硫酸混合,发生反应为:Ba2++SO42-=BaSO4↓,根据硫酸根和钡离子的量计算产生沉淀的质量;
(2)反应后氢离子物质的量不变,但是浓度变化,根据c=$\frac{n}{V}$计算氢离子浓度,根据pH=-lgc(H+)计pH即可.
解答 解:(1)氯化钡和硫酸混合,发生反应为:Ba2++SO42-=BaSO4↓,50mL 0.1mol/L BaCl2中钡离子的物质的量:0.05L×0.1mol/L=0.005mol,100mL 0.75mol/L H2SO4溶液中硫酸根离子的物质的量:0.1L×0.75mol/L=0.075mol,所以产生硫酸钡的物质的量0.005mol,质量是0.005mol×233g/mol=1.165g,
答:产生沉淀1.165克;
(2)100mL 0.75mol/L H2SO4溶液中氢离子的物质的量=0.75mol/L×0.1L×2=0.15mol,混合后,氢离子的物质的量不变,但是浓度变化,c=$\frac{n}{V}$=$\frac{0.15mol}{0.15L}$=1mol/L,pH═-lgc(H+)=0.
答:反应后溶液的pH为0.
点评 本题考查学生离子方程式的有关计算以及pH的计算,注意硫酸和氯化钡反应前后氢离子的物质的量不变这一点,难度中等.

练习册系列答案
相关题目
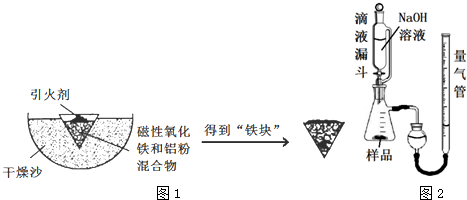
1.新疆是我国的主要产棉地,棉产品市场的开发在西部大开发中占有举足轻重的地位,现测得新疆某地棉花纤维的平均相对分子质量约为5.8×105,则该地棉花纤维分子中平均含有的葡萄糖结构单元的数量最接近于( )
| A. | 3.2×102 | B. | 3.5×102 | C. | 3.2×103 | D. | 3.6×103 |
18.用惰性电极电解1L 0.2mol/L的CuSO4溶液,电解过程中转移电子数为0.6mol,向所得溶液中加入一定量的下列某种物质后恰好恢复到电解前的浓度和pH,则该物质为( )
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
9.下列排列顺序错误的是( )
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题: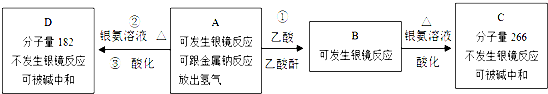
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$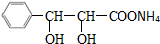 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或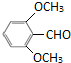 )
)
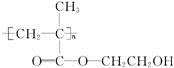 .
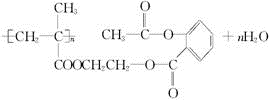
.
 .
.