题目内容
20.标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )| A. | H2与C2H4 | B. | CO与C2H4 | C. | CO 与C3H6 | D. | H2与C4H6 |
分析 碳酸钙物质的量为$\frac{15g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,由此分析解答.
解答 解:碳酸钙物质的量为$\frac{15g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,
A、等物质的量的H2与C2H4,平均为:CH3,不合题意,故A错误;
B、等物质的量的CO与C2H4,平均为:CH2O 0.5,不合题意,故B错误;
C、等物质的量的CO 与C3H6,平均为:C2H3O 0.5,不合题意,故C错误;
D、等物质的量的H2与C4H6,平均为:C2H4,合题意,故D正确;
故选D.
点评 本题考查有机物推断,注意利用平均组成进行解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有关能量转换的说法正确的是( )
| A. | 煤燃烧是化学能转化为热能的过程 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
15.下列分离提纯的方法不正确的是( )
| 选项 | 混合物 | 分离、提纯方法 | 选项 | 混合物 | 分离、提纯方法 |
| A | 分离苯和水 | 分液法 | B | 除去乙炔中H2S气体 | 用CuSO4溶液洗气 |
| C | 分离乙醇和甲醇 | 蒸馏法 | D | 除去水中的少量苯酚 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.工业上可用下列装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)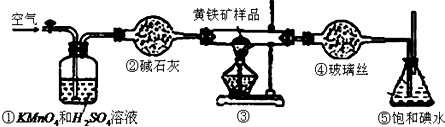
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)装置④的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流.
(5)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为24.0%(保留小数点后1位).
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)装置④的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流.
(5)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.
12.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的正戊烷完全燃烧需要氧气分子数为4NA | |
| B. | 标准状况下,22.4L乙烷中所含电子对数目为6NA | |
| C. | 26g乙炔和苯的混合物,含有原子总数为4NA | |
| D. | 标准状况下,22.4L甲烷与氯气光照取代发生一氯取代,需要氯气0.5NA |
10.氨既是重要工业产品又是化工原料,由氨可以制备一系列物质(见图),下列说法正确的是( )
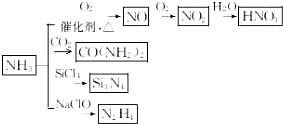

| A. | 图中所述反应都发球氧化还原反应 | |
| B. | CO(NH2)2与氰酸铵(NH4CNO)互为同素异形体 | |
| C. | Si3N4属于离子化合物 | |
| D. | NH3与NaClO反应,N2N4是氧化产物 |
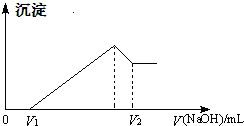 将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答: