题目内容
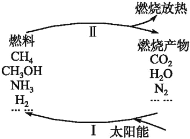
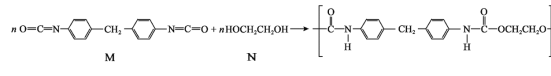
【题目】近年来将氯化氢转化为氯气的技术成为科学研究的热点。
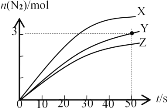
(1)迪肯发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为密闭容器中, 进料浓度比 c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度 变化的关系:
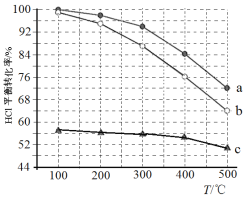
①据图像可知反应平衡常数 K(300℃)______K(400℃),(填“>”或“<”)。判 断理由是:________________________________________________;
②若进料浓度比 c(HCl) ∶c(O2)等于 1∶1,400℃时,O2 的转化率是______。
(2)Deacon 直接氧化法可按下列催化过程进行:CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1,4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计 了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
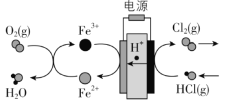
阴极区发生的反应有Fe3+ + e- = Fe2+和___________________(写反应方程式)。
电路中转移1 mol电子,可生成氯气__________L(标准状况)。
【答案】> 图像表明,进料浓度比相同时温度升高HCl的平衡转化率降低,说明平衡逆向移动,生成物浓度降低,反应物浓度升高,K值越小。 21% CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s) 4Fe2++O2+4H+=4Fe3++2H2O 11.2
Cl2(g) = CuCl2(s) 4Fe2++O2+4H+=4Fe3++2H2O 11.2
【解析】
(1)①根据图知,进料浓度比c(HCl):c(O2)一定时,升高温度,HCl的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,则正反应为放热反应,温度越高,化学平衡常数越小。
②温度一定时,进料浓度比c(HCl):c(O2)越大,HCl的转化率越小,400℃进料浓度比c(HCl):c(O2)=1:1时,HCl的转化率为a曲线,HCl转化率为84%,根据三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
开始(mol/L) c0c000
反应(mol/L) 0.84c00.21c00.42c00.42c0
平衡(mol/L) 0.16c00.79c00.42c00.42c0
计算氧气的转化率。
(2)①CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1;
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1;
③4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,![]() ③-②-①得:需要利用CuCl2(s)=CuCl(s)+
③-②-①得:需要利用CuCl2(s)=CuCl(s)+![]() Cl2(g)或CuCl(s)+
Cl2(g)或CuCl(s)+![]() Cl2(g) = CuCl2(s)的ΔH。
Cl2(g) = CuCl2(s)的ΔH。
(3)由图可知,H+向左侧移动,则左侧为电解池的阴极,阴极上发生还原反应,根据图示信息可知,其阴极电极反应式为:Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O,右侧为阳极,阳极电极反应式为:2HCl-2e-=Cl2↑+2H+。
(1)①根据图知,进料浓度比c(HCl):c(O2)一定时,升高温度,HCl的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,则正反应为放热反应,温度越高,化学平衡常数越小,所以K(300℃)>K(400℃),故答案为:>;图像表明,进料浓度比相同时温度升高HCl的平衡转化率降低,说明平衡逆向移动,生成物浓度降低,反应物浓度升高,K值越小。
②温度一定时,进料浓度比c(HCl):c(O2)越大,HCl的转化率越小,400℃进料浓度比c(HCl):c(O2)=1:1时,HCl的转化率为a曲线,HCl转化率为84%,根据三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
开始(mol/L) c0c000
反应(mol/L) 0.84c00.21c00.42c00.42c0
平衡(mol/L) 0.16c00.79c0
则氧气的转化率为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)①CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH1=-20 kJ·mol-1;
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH2=-121 kJ·mol-1;
③4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
若是利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,![]() ③-②-①得:需要利用CuCl2(s)=CuCl(s)+
③-②-①得:需要利用CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s)的ΔH,故答案为:CuCl2(s)=CuCl(s)+
Cl2(g) = CuCl2(s)的ΔH,故答案为:CuCl2(s)=CuCl(s)+![]() Cl2(g) 或CuCl(s)+
Cl2(g) 或CuCl(s)+![]() Cl2(g) = CuCl2(s)。
Cl2(g) = CuCl2(s)。
(3)由图可知,H+向左侧移动,则左侧为电解池的阴极,阴极上发生还原反应,根据图示信息可知,其阴极电极反应式为:Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O,右侧为阳极,阳极电极反应式为:2HCl-2e-=Cl2↑+2H+,电路中转移1mol电子,生成0.5molCl2,其标准状况下的体积为![]() ,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;![]() 。
。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案