题目内容
17.以苯甲醛为原料制取苯甲醇和苯甲酸的合成反应如下: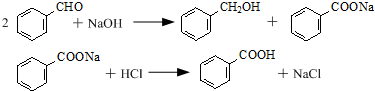
相关物质的部分物理性质见下表:
| 名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醚 | ||||
| 苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
| 苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
| 苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
| 乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | -- |

(1)萃取时苯甲醇在分液漏斗的上层(填“上”或“下”)层,分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是排放可能产生的气体以解除超压.
(2)用NaHSO3溶液、10%Na2CO3溶液、H2O洗涤乙醚层.
①用10%Na2CO3溶液洗涤目的是除去乙醚中溶解的少量苯甲酸.
②操作Ⅰ名称是蒸馏.
(3)抽滤操作结束时先后进行的操作是先断开抽滤瓶与抽气泵的连接,后关闭抽气泵.
(4)提纯粗产品乙的实验方法为重结晶.
分析 苯甲醛反应得到苯甲醛与苯甲酸钠,用乙醚萃取分液,乙醚层中溶解苯甲醇,经过蒸馏得到甲为苯甲醇.水层中含有苯甲酸钠,加入与盐酸得到苯甲酸,冷却有利于苯甲酸析出,抽滤分离提纯.
(1)乙醚的密度比水的小,乙醚层在上层;排放可能产生的气体以解除超压;
(2)①除去乙醚中溶解的少量苯甲酸
②操作I分离互溶液体物质;
(3)抽滤操作结束时,先断开抽滤瓶与抽气泵的连接,后关闭抽气泵;
(4)利用重结晶方法进行提纯.
解答 解:苯甲醛反应得到苯甲醛与苯甲酸钠,用乙醚萃取分液,乙醚层中溶解苯甲醇,经过蒸馏得到甲为苯甲醇.水层中含有苯甲酸钠,加入与盐酸得到苯甲酸,冷却有利于苯甲酸析出,抽滤分离提纯.
(1)乙醚的密度比水的小,乙醚层在上层,即萃取时苯甲醇在分液漏斗的上层;分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是:排放可能产生的气体以解除超压,
故答案为:上层;排放可能产生的气体以解除超压;
(2)①用10%Na2CO3溶液洗涤目的是:除去乙醚中溶解的少量苯甲酸,故答案为:除去乙醚中溶解的少量②操作I分离互溶液体物质,采取蒸馏方法,故答案为:蒸馏;
(3)抽滤操作结束时,先断开抽滤瓶与抽气泵的连接,后关闭抽气泵,故答案为:先断开抽滤瓶与抽气泵的连接,后关闭抽气泵;
(4)提纯粗产品苯甲酸的实验方法为重结晶,故答案为:重结晶.
点评 本题考查有机物合成实验,涉物质的分离提纯、化学实验基本操作等,注意对题目信息的运用,有利于培养学生的实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.液氨与水的电离相似,存在着微弱的电离:2NH3?NH4++NH2-.对该体系的说法中正确的是( )
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |
8.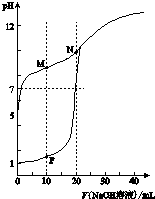 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
12.下列能量转化过程中没有化学能变化的是( )
| A. | 氯化铵热分解反应 | B. | 氮气和氢气化合生成氨的反应 | ||
| C. | 碘升华 | D. | 绿色植物的光合作用生成淀粉 |
6.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
7.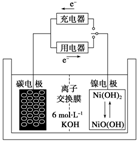 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
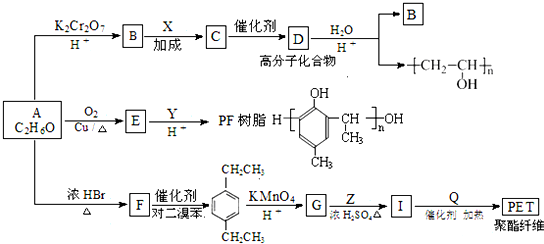
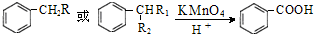 (R为H原子或烃基)
(R为H原子或烃基)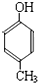
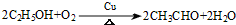
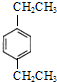 的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为
的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为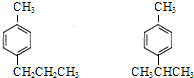

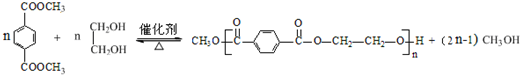 .
.