��Ŀ����
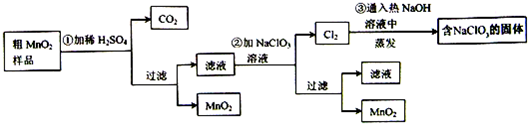
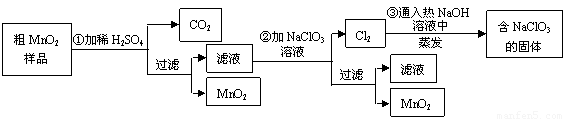
��20�֣�MnO2��һ����Ҫ�Ĺ��������ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2��ֻ���н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��1���ڢٲ���ϡH2SO4ʱ������MnO2��Ʒ�� �� ���� ��д��ѧʽ��ת��Ϊ���������ʡ�
��2���ڢڲ���Ӧ�����ӷ���ʽ�ǣ�������������ƽ���� Mn2+ �� ClO3���� �� MnO2���� Cl2���� ��
��3���ڢ۲������������������������̨������Ȧ���� �� �� �� ����������
��4������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224LCO2����״���£������ڵڢٲ���Ӧ��������Ҫ�� mol H2SO4��д��������� ����֪Ħ��������MnO2 -87g/mol�� MnO-71g/mol�� MnCO3-115 g/mol��
��5����֪2H2O2��l����2H2O��l����O2��g�� ��H��a kJ��mol-1 ��Ӧ���̵������仯��ͼ��ʾ����
�� �÷�ӦΪ �� ��Ӧ������ȡ����ȡ�����
��������������ͼ�л���ʹ��MnO2������������·�Ӧ��������ϵ�����仯ʾ��ͼ��

 |
��20�֣���1��MnO2 MnCO3��ÿ��2����
��2��5Mn2++2ClO3-+4H2O=5MnO2��+Cl2��+8H+��4�֣���������ȫ�Ը�2�֣���ƽ2�֣���
��3�������� �ƾ��ƣ�4�֣���
��4��0.05��4�֣���
��5�������ȣ�2�֣�����ͼ�ԣ�2�֣�
����������

 ��У����ϵ�д�
��У����ϵ�д�MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�� ����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��֪�ڢ� ����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2��
����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2�� + 8H+
+ 8H+
����������ɵ�41~46�⣺
41���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ������ ���ʡ�
���ʡ�
42��д���ڢ۲���Ӧ�Ļ�ѧ����ʽ  ��
��
43��ʵ��������ɵڢ۲������������������������̨������Ȧ���� �� ����������
44���������п���ѭ��ʹ�õ������� ��
45������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224 L CO2����״���£������ڵڢٲ���Ӧ��������Ҫ mol H2SO4��
46����֪2H2O2(l) �� 2H2O(l) ��O2(g)����Ӧ���̵������仯��ͼ��ʾ��
 |
�ٸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
������������ͼ�л���ʹ��MnO2������������·�Ӧ��������ϵ�����仯ʾ��ͼ��

 +
+