题目内容
(12分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
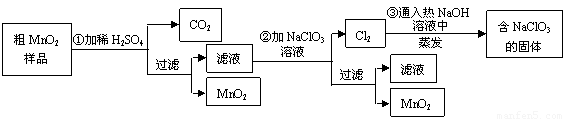
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式
 +
+ ClO3-+
ClO3-+ =
= MnO2+
MnO2+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要 mol NaClO3
【答案】
(1)MnO和MnCO3;(2分)(2)5Mn2+ + 2ClO3-+ 4H2O=5MnO2 + Cl2↑+ 8H+ ;(3分)(3)酒精灯、蒸发皿、玻璃棒;(各1分)NaCl;(2分)(4)0.02mol。(2分)
【解析】略

练习册系列答案
相关题目
 +
+