题目内容
11. 相同质量的四块金属片组装成如下的两套装置,其中说法正确的是( )
相同质量的四块金属片组装成如下的两套装置,其中说法正确的是( )| 选项 | 评估项目 | 甲装置 | 乙装置 |
| A | 能量转化的主要形式 | 化学能转化为电能 | 无能量转化 |
| B | 金属片的质量 | 锌片减轻,铜片增重 | 锌片增重,铜片不变 |
| X | SO42-移动方向 | 移向锌片 | 移向锌片 |
| D | 锌片与铜片的质量相差12.9g时,转移电子的物质的量 | 转移0.2mol电子 | 转移25.8mol电子 |
| A. | A | B. | B | C. | C | D. | D |
分析 甲装置构成原电池,活泼金属锌作负极,溶解后质量减轻,电极反应为:Zn-2e-=Zn2+,铜作正极,溶液中铜离子在正极得电子产生铜,电极反应为:Cu2++2e-=Cu,正极会增重;乙装置不能构成原电池,铜的质量不变,锌片上发生置换反应:Zn+Cu2+=Zn2++Cu,锌-65,铜-64,则锌片质量减轻,据此分析解答.
解答 解:A.甲装置构成原电池,将化学能转化为电能,乙装置发生置换反应,是一个放热反应,化学能转化为热能,故A错误;
B.甲装置构成原电池,活泼金属锌作负极,溶解后质量减轻,铜作正极,溶液中铜离子在正极得电子产生铜,正极会增重;乙装置不能构成原电池,铜的质量不变,锌片上发生置换反应:Zn+Cu2+=Zn2++Cu,锌-65,铜-64,则锌片质量减轻,故B错误;
C.甲装置构成原电池,活泼金属锌作负极,阴离子移向负极;乙装置不能构成原电池,无离子定向移动,故C错误;
D.甲装置:正极Cu上会有铜单质析出,而变粗,其电极反应为:Cu2++2e-=Cu;则电池总反应为Zn与铜离子的反应,为Zn+Cu2+=Zn2++Cu,正极:Cu2++2e-=Cu,负极:Zn-2e-=Zn2+,设电路中转移电子的物质的量为n,则正极质量增加32n,负极质量减少32.5n,所以32.5n+32n=12.9g,解得n=0.2mol;
乙装置:铜的质量不变,锌片上发生置换反应:Zn+Cu2+=Zn2++Cu,锌-65,铜-64,则质量减轻1g时,电子转移2mol,当质量减轻12.9g时,电子转移25.8mol,
故D正确;
故选D.
点评 本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,注意把握原电池的构成条件、电极方程式的书写等基础知识的积累,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生聚沉而沉淀,继续加入时沉淀消失.这种液体是( )
| A. | 0.5mol•L-1食盐溶液 | B. | 0.5mol•L-1NaHSO4溶液 | ||
| C. | 0.5mol•L-1氯化钾溶液 | D. | 蒸馏水 |
6. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
16.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和3-甲基-1-丁烯 | B. | 甲苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基环己烷和己烯 |
20.下列变化一定属于化学变化的是( )
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
| A. | ①②③④⑦ | B. | ③④⑤⑦⑨ | C. | ①③⑤⑦⑨ | D. | ①③④⑦⑩ |
1.表是A、B两种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为  |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
. 
 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)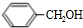 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.


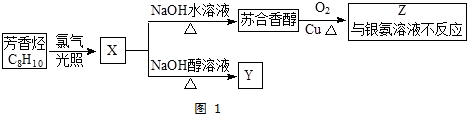
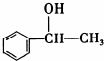 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.
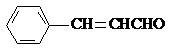 .
.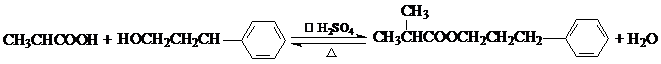 .
.
 ;
; ;
; ;
; .
.