题目内容
BaCl2和NaCl的混合溶液aL,将其分为两等份。一份滴加5%的硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗 n mol H2SO4, m mol AgNO3,据此得知原混合溶液中的c(Na+)(mol·L-1)为
A.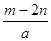 | B.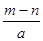 | C.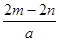 | D.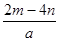 |
D
解析试题分析:此过程中发生的反应为: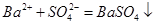 、
、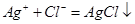 ,由此可知原混合溶液中
,由此可知原混合溶液中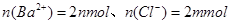 ,因此溶液中
,因此溶液中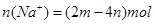 ,其浓度
,其浓度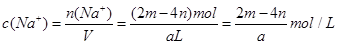 ,故答案为D。
,故答案为D。
考点:化学方程式的计算
点评:此题属于基础题,只要掌握“溶液的电中性”,即可求出溶液中n(Na+),则可得出正确答案。

练习册系列答案
相关题目
有BaCl2和NaCl的混合溶液2.0L,将它平均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗0.5mol H2SO4、2.0mol AgNO3.据此得知原混合溶液中的C(Na+)为( )
| A、0.5 mol?L-1 | B、0.75 mol?L-1 | C、1.5 mol?L-1 | D、1.0 mol?L-1 |