题目内容
10.证明海带中含有碘元素的实验方案如下,请你按要求补充完整:| 步骤 | 实验过程 | 实验用品 |
| I | 将干海带灼烧灰化 | 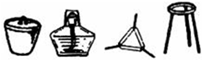 |
| II | 将海带灰溶解、过滤 | 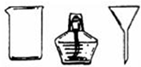 和①玻璃棒 和①玻璃棒 |
| III | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O | 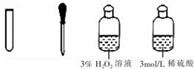 |
| IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素 |  |
分析 ①溶解需要烧杯和玻璃棒,过滤需要漏斗;
②双氧水与碘离子发生氧化还原反应生成碘单质和水;
③碘单质易溶于四氯化碳,则混合液分层,根据四氯化碳的密度及碘单质的颜色进行解答.
解答 解:①海带灰溶解、过滤时使用烧杯、普通漏斗、玻璃棒、铁架台等,还缺少玻璃棒,
故答案为:玻璃棒;
②双氧水具有强氧化性,能够氧化滤液中的碘离子,反应的离子方程为:2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O;
③碘单质易溶于有机溶剂四氯化碳,且四氯化碳密度大于水,则混合液会分层,下层溶液变为紫红色,
故答案为:下层溶液变为紫红色.
点评 本题考查物质的鉴别实验,为高频考点,把握仪器的使用、氧化还原反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列物质中,不属于合金的是( )
| A. | 硬铝 | B. | 黄铜 | C. | 不锈钢 | D. | 水银 |
1.下列化合物不属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 油脂 | C. | 纤维素 | D. | 蛋白质 |
18.有关苯分子的说法不正确的是( )
| A. | 苯分子中C原子均以sp3杂化方式成键,形成夹角为120°的三个sp3杂化轨道,故为正六边形的碳环 | |
| B. | 每个碳原子还有一个未参与杂化的2p轨道,垂直碳环平面,相互交盖,形成大π键 | |
| C. | 大π键中6个电子被6个C原子共用,故称为6中心6电子大π键 | |
| D. | 苯分子中共有十二个原子共面,六个碳碳键完全相同 |
5.在四个不同的容器中,在不同的条件下进行合成氨反应:N2(g)+3H2(g)?2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是( )
| A. | v(H2)=0.2mol•L-1•min-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(N2)=0.02 mol•L-1•s-1 | D. | v(H2)=0.04 mol•L-1•s-1 |
15.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期第ⅦA族;R在自然界中有质量数为35和37的两种核素,它们之间的关系为互为同位素.
(2)Z的单质与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc.
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:XR>YX4
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3
(4)根据表中数据推测Y的原子半径的范围:0.099nm<rY<0.143nm.
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙+水,则丙的化学式为NaAlO2(Na2SiO3或NaClO4)(写出一种即可).
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc.
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:XR>YX4
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3
(4)根据表中数据推测Y的原子半径的范围:0.099nm<rY<0.143nm.
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙+水,则丙的化学式为NaAlO2(Na2SiO3或NaClO4)(写出一种即可).
2.下列关于有机化合物的认识正确的是( )
| A. | 甲烷、苯都不能发生氧化反应 | |
| B. | 乙烯、聚乙烯都可与溴水发生加成反应 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇类物质生成 |
19.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与稀硫酸的反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O | |
| B. | 硫酸铝溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑ |
20.能将NH4Cl、AlCl3、Na2SO4三瓶溶液鉴别开的试剂是( )
| A. | NaOH 溶液 | B. | AgNO3 溶液 | C. | BaCl2 溶液 | D. | 盐酸 |