题目内容
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如图:

(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 .
(2)沉淀池中发生反应的化学反应方程式是 ,从沉淀池中分离沉淀的操作是 .
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 .
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号).
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 .
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 .

(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是
(2)沉淀池中发生反应的化学反应方程式是
(3)氨碱法生产流程示意图中的Y是
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:(1)氨气极易溶于水,二氧化碳在水中的溶解度较小;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;根据过滤的原理和适用范围回答;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(4)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度;加入食盐细粉目的是提高Cl-的浓度,使氯化氨析出;
(5)与氨碱法比较,联合制碱法优点是提高了原料的原子利用率,避免产生大量的含有CaCl2的溶液,节省石灰窑、蒸氨塔等设备;
(6)根据质量守恒定律可知,加热至质量不再改变,反应后生成的二氧化碳和水的质量之和为(a-b)g,据此求出碳酸钠的质量,再用碳酸钠的质量除以样品质量即可;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;根据过滤的原理和适用范围回答;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(4)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度;加入食盐细粉目的是提高Cl-的浓度,使氯化氨析出;
(5)与氨碱法比较,联合制碱法优点是提高了原料的原子利用率,避免产生大量的含有CaCl2的溶液,节省石灰窑、蒸氨塔等设备;
(6)根据质量守恒定律可知,加热至质量不再改变,反应后生成的二氧化碳和水的质量之和为(a-b)g,据此求出碳酸钠的质量,再用碳酸钠的质量除以样品质量即可;
解答:
解:(1)二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳,
故答案为:因为CO2溶解度小,而NH3易溶于水,先通入NH3有利于后面CO2的吸收;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,从沉淀池中分离沉淀NaHCO3晶体,可用过滤的方法,故答案为:NH3+CO2+NaCl+H2O═NaHCO3↓+NH4Cl;过滤;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,
故答案为:NH3; CaCO3+2NaCl═Na2CO3+CaCl2;
(4)a.常温时氯化铵的溶解度比氯化钠大,故a错误;
b.通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c.加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
d.通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故d正确;
故选bd;
(5)联合制碱法的主要原理是:①向浓氨水中通入足量的CO2后,氨气、水和CO2发生化合反应而生成NH4HCO3溶液;②然后加入食盐细粒充分搅拌,生成的碳酸氢钠和氯化铵;③将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水,相对于氨碱法制碱,即向过滤后的滤液中加熟石灰以回收氨,使之循环使用能够避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备,
故答案为:避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备;
(6)设原混合物中碳酸钠的质量为X,
2NaHCO3
Na2CO3+H2O+CO2↑ 固体减少的质量
168 106 18 44 62
(a-x)g (a-b)g
列比例式:
=
解得X=
,所以纯碱的质量分数为:
×100%,
故答案为:
×100%;
故答案为:因为CO2溶解度小,而NH3易溶于水,先通入NH3有利于后面CO2的吸收;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,从沉淀池中分离沉淀NaHCO3晶体,可用过滤的方法,故答案为:NH3+CO2+NaCl+H2O═NaHCO3↓+NH4Cl;过滤;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,
故答案为:NH3; CaCO3+2NaCl═Na2CO3+CaCl2;
(4)a.常温时氯化铵的溶解度比氯化钠大,故a错误;
b.通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c.加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
d.通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故d正确;
故选bd;
(5)联合制碱法的主要原理是:①向浓氨水中通入足量的CO2后,氨气、水和CO2发生化合反应而生成NH4HCO3溶液;②然后加入食盐细粒充分搅拌,生成的碳酸氢钠和氯化铵;③将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水,相对于氨碱法制碱,即向过滤后的滤液中加熟石灰以回收氨,使之循环使用能够避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备,
故答案为:避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备;
(6)设原混合物中碳酸钠的质量为X,
2NaHCO3
| ||
168 106 18 44 62
(a-x)g (a-b)g
列比例式:
| 168 |
| a-x |
| 62 |
| a-b |
| 84b-53a |
| 31 |
| 84b-53a |
| 31a |
故答案为:
| (84b-53c) |
| 31a |
点评:本题考查了联碱法和氨碱法生产流程的原理比较和物质分析判断,明确碳酸钠、碳酸氢钠、氨气、二氧化碳的性质,掌握工艺流程和反应原理是解题关键,题目难度中等.

练习册系列答案
相关题目
 如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )| 选项 | X | Y | Z |
| A | 混合物 | 溶液 | 胶体 |
| B | 酸 | 强酸 | 硫酸 |
| C | 纯净物 | 无机物 | 甲烷 |
| D | 化合物 | 碱性氧化物 | 酸性氧化物 |
| A、A | B、B | C、C | D、D |
下列实验操作正确的是( )
A、 制氨气 |
B、 收集CO2或NO |
C、 配制稀硫酸 |
D、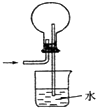 氨气的吸收 |
如图是制取和收集气体的实验装置,该装置可用于( )


| A、用浓盐酸跟二氧化锰反应制取Cl2 |
| B、用浓氨水和生石灰制取NH3 |
| C、用电石跟水反应制取C2H2 |
| D、用浓硝酸跟铜反应制取NO2 |
 有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验: 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.