题目内容
8.均衡的膳食结构可以保障身体健康.①维生素C又称抗坏血 酸.维生素C具有较强的还原性 (选填“碱性”、“氧化性”或“还原性”).
②糖类、油脂、蛋白质都能为人体提供能量,等质量的上述物质提供能量最多的是油脂.
③请写出检验淀粉水解是否生成葡萄糖的实验方法和现象:取少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制银氨溶液,水浴加热,试管内壁有银镜生成,说明淀粉水解生成了葡萄糖(或:少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制的碱性氢氧化铜悬浊液,加热,观察到有红色沉淀生成,说明淀粉水解生成了葡萄糖).
分析 ①维生素C称为抗坏血酸,具有酸性和有很强的还原性,以此分析;
②每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ;
③葡萄糖在碱性条件下能与银氨溶液反应生成银镜.
解答 解:①维生素C由于它能防治坏血病,又称为抗坏血酸,有很强的还原性,易被氧化,故答案为:抗坏血;还原性;
②每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ,提供能量最多的是油脂,故答案为:油脂;
③葡萄糖在碱性条件下能与银氨溶液水浴加热反应生成银镜,具体操作为取少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制银氨溶液,水浴加热,试管内壁有银镜生成,说明淀粉水解生成了葡萄糖(或:少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制的碱性氢氧化铜悬浊液,加热,观察到有红色沉淀生成,说明淀粉水解生成了葡萄糖),
故答案为:取少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制银氨溶液,水浴加热,试管内壁有银镜生成,说明淀粉水解生成了葡萄糖(或:少量待测液于试管中,加入适量NaOH溶液至弱碱性,再加入新制的碱性氢氧化铜悬浊液,加热,观察到有红色沉淀生成,说明淀粉水解生成了葡萄糖).
点评 本题考查营养物质、微量元素、葡萄糖的检验等,题目难度不大,注意利用化学知识来解决生活中的问题.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
18.下列叙述不正确的是( )
| A. | 氨水中:c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(OH-) | |
| B. | 饱和H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-) | |
| C. | 0.1mol/LCH3COOH溶液中:c(H+)-c(OH-)=c(CH3COO-) | |
| D. | NaOH溶液中:c(H+)+c(Na+)=c(OH-) |
19. “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,光能和电能全部转化为化学能 | |
| B. | 该装置工作时,H+向b极板移动 | |
| C. | 反应6CO2+8H2O$\frac{\underline{\;\;\;光\;\;\;}}{通电}$2C3H8O+9O2,每消耗1 mol CO2 转移4 mol电子 | |
| D. | 电极a上CO2参与的电极反应为:3CO2+18H++18e-═C3H8O+5H2O |
16.下列有关实验操作正确的是( )
| A. |  除去Cl2中的HCl 除去Cl2中的HCl | B. |  制备蒸馏水 制备蒸馏水 | ||
| C. |  萃取碘水中碘 萃取碘水中碘 | D. |  称量氢氧化钠固体 称量氢氧化钠固体 |
3.下列对各物质性质的解释不正确的是
( )
| 选项 | 性质 | 原因 |
| A | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | 重金属盐中毒可服用牛奶解毒 | 牛奶中蛋白质变性,保护了人体的蛋白质 |
| D | 明矾用来净水 | Al3+水解生成Al(OH)3胶体,具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学用语表达正确的是( )
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: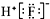 | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: |
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
17.一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )


| A. | 右边CO与CO2分子数之比为3:1 | |
| B. | 右侧CO的质量为2.75g | |
| C. | 右侧气体密度是相同条件下氧气密度的16倍 | |
| D. | 若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入情况容器内的压强之比为24:25 |
18.如图的装置为实验室模拟铜的精练.以下叙述正确的是( )


| A. | c为纯铜,d为粗铜 | |
| B. | 实验前,铜片可用热碱溶液除油渍,盐酸除铜绿 | |
| C. | 用含Cu2+的盐配成电解质溶液,电解后其浓度保持不变 | |
| D. | 若阴极得到2摩尔电子,则阳极质量减少64克 |