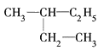
题目内容
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )

A. a处通入氧气,b处通入氢气
B. 该装置中只涉及两种形式的能量转化
C. P一型半导体连接的是电池负极
D. 电池正极电极反应式为O2+2H2O+4e—=4OH—
【答案】D
【解析】
A、根据LED中电子移动方向可判断N型半导体与电池负极相连,则a处为负极,应该通入氢气,b处通入氧气,A错误;
B、该装置主要涉及化学能、电能、光能三种形式的能量转化,B错误;
C、P型半导体与电池正极相连,C错误;
D、O2在正极反应,电解质溶液为KOH,正极电极反应式为O2+2H2O+4e-=4OH-,D正确;
答案选D。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是X__________,Y__________,Z__________,T__________,U__________
(2)Y原子的结构示意图为__________
(3)用电子式表示Y与T组成的化合物的形成过程:__________
(4) YX2和U2Y反应的化学方程式为_______________________,其中氧化剂是__________,被氧化的元素是_______。