题目内容
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
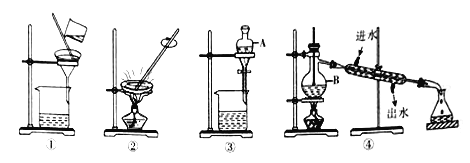
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
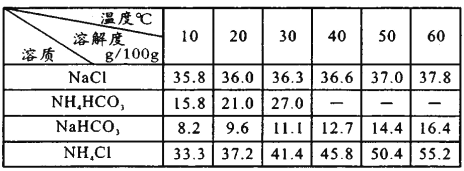
已知各物质在不同温度下的溶解度见右表。
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
【答案】 CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,无明显现象,则已洗净,否则未洗净 氯化钡或BaCl2 碳酸钠或Na2CO3 饱和碳酸氢钠溶液 Na++CO2+H2O+NH3=NaHCO3↓+NH4+(或Na++HCO3-=NaHCO3↓) 水浴加热 温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小会析出,使产率偏低
【解析】(1)反应池中生成碳酸钙和氯化铵,发生反应的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl。(2)得到超细碳酸钙表面含有氯离子,所以可以通过检验氯离子判断固体是否洗净,其操作是取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,无明显现象,则已洗净,否则未洗净。(3)I. Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,过滤后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即依次加入足量NaOH溶液、氯化钡溶液、碳酸钠溶液,过滤,加入盐酸调pH至7。①A装置制备二氧化碳,由于生成的二氧化碳中含有氯化氢,所以B中应盛装饱和碳酸氢钠溶液,用来除去二氧化碳中的氯化氢。②C装置中生成NaHCO3的离子方程式是Na++CO2+H2O+NH3=NaHCO3↓+NH4+。③“转化”过程中,温度控制在30~35℃之间的加热方式是水浴加热;根据表中数据可知温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小会析出,使产率偏低,所以温度需控制在30~35℃之间。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案