题目内容
12.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1mol•L-1NaClO溶液中:Na+、K+、I-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:NH4+、SCN-、Na+、SO42- |
分析 A.该组离子之间不反应;
B.pH=13的溶液,显碱性;
C.离子之间发生氧化还原反应;
D.离子之间结合生成络离子.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.pH=13的溶液,显碱性,不能大量存在HCO3-,故B错误;
C.I-、ClO-发生氧化还原反应,不能共存,故C错误;
D.SCN-、Fe3+结合生成络离子,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应及络合反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
2.已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性.ICl跟Zn,H2O分别发生如下反应:2ICl+2Zn=ZnCl2+ZnI2,ICl+H2O=HCl+HIO.下列说法正确的是( )
| A. | 在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 | |
| B. | 在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 | |
| C. | 在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 | |
| D. | 在H2O跟ICl的反应中,ICl是氧化剂 |
3.五种短周期元素在元素周期表中的相对位置如表所示,其中E的非金属性在同周期元素中最强,下列说法正确的是( )
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
20.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
7.下列有关说法正确的是( )
| A. | 光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾 | |
| B. | pH小于7的雨水都是酸雨 | |
| C. | PM2.5含量的增加是形成雾霾天气的重要原因之一 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |
17.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
| 选项 | X | Y | Z | 箭头上为反应条件或试剂 |  |
| A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
| B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2、再通过量NH3 | |
| C | SiO2 | Na2SiO3 | H2SiO3 | ③加热 | |
| D | NaAlO2 | Al(OH)3 | Al2O3 | ④加H2O |
| A. | A | B. | B | C. | C | D. | D |
1.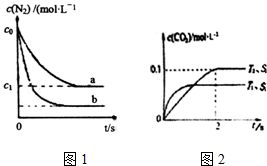 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
(1)汽车内燃机工作时发生反应N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T0℃时将等物质的量的N2(g)和O2(g)充入恒容密闭容器中发生反应,图1曲线a表示该反应在T0℃下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是ad.
a.温度T0℃下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$
b.温度T0℃下,随着反应的进行,混合气体的密度减小
c.曲线b对应的条件改变可能是充入了NO气体
d.若曲b对应的条件改变是温度,可判断△H>0
(2)汽车安装尾气催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H.某科研小组为了探究催化剂的效果,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
①2~3s间的平均反应速率v(N2)=4.5×10-5mol•L-1•S1.
②在该温度下,反应的平衡常数K=5000.
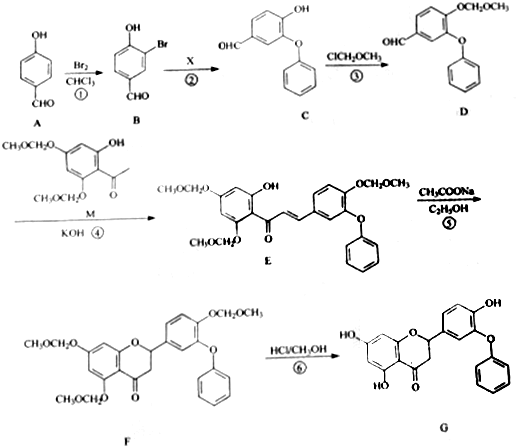
③在使用等质量催化剂时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,CO2的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.由此可知该反应的△H<0(填“>”“<”),原因是温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0.
若催化剂的表面积S1>S2,在图2中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④假设在密闭容器中发生上述反应,达到平衡时能提高NO转化率的措施是降低反应体系的温度或缩小容器的体积.
(3)用NH3还原NOx生成N2和H2O也可以减少污染.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.(1)汽车内燃机工作时发生反应N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T0℃时将等物质的量的N2(g)和O2(g)充入恒容密闭容器中发生反应,图1曲线a表示该反应在T0℃下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是ad.
a.温度T0℃下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$
b.温度T0℃下,随着反应的进行,混合气体的密度减小
c.曲线b对应的条件改变可能是充入了NO气体
d.若曲b对应的条件改变是温度,可判断△H>0
(2)汽车安装尾气催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H.某科研小组为了探究催化剂的效果,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
②在该温度下,反应的平衡常数K=5000.
③在使用等质量催化剂时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,CO2的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.由此可知该反应的△H<0(填“>”“<”),原因是温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0.
若催化剂的表面积S1>S2,在图2中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④假设在密闭容器中发生上述反应,达到平衡时能提高NO转化率的措施是降低反应体系的温度或缩小容器的体积.
(3)用NH3还原NOx生成N2和H2O也可以减少污染.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
 .
.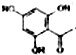 制得,写出同时满足下列条件的
制得,写出同时满足下列条件的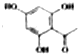 的一种同分异构体的结构简式
的一种同分异构体的结构简式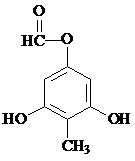 或
或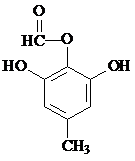 .
. 为原料,合成
为原料,合成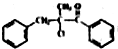 ,写出合成流程图
,写出合成流程图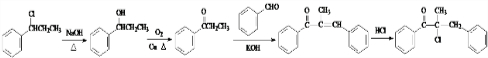 (无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
(无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. .
.