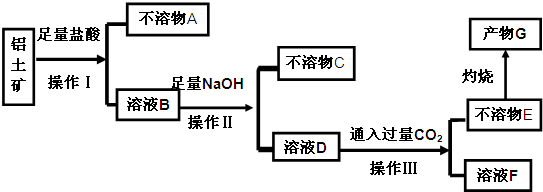
题目内容
有一表面被氧化成氧化钠的金属样品5.22克,投入到100克水中,产生氢气0.2克.求:
(1)此样品中钠的纯度?
(2)所得溶液溶质的质量分数?
(1)此样品中钠的纯度?
(2)所得溶液溶质的质量分数?
考点:化学方程式的有关计算
专题:
分析:(1)根据反应2Na+2H2O=2NaOH+H2↑,利用氢气的质量,计算样品中Na的质量;
(2)根据(1)中的Na的质量可计算氧化钠的质量,根据氧化钠中Na元素质量分数计算被氧化成氧化钠的金属钠的质量,求可计算Na元素的质量,利用n=
计算其物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,溶液质量=10.8+100g-生成氢气的质量,结合质量分数定义计算.
(2)根据(1)中的Na的质量可计算氧化钠的质量,根据氧化钠中Na元素质量分数计算被氧化成氧化钠的金属钠的质量,求可计算Na元素的质量,利用n=
| m |
| M |
解答:
解:(1)设样品中钠的质量为x,
2Na+2H2O=2NaOH+H2↑
46 2
x 0.2g
=
x=4.6g
此样品中钠的纯度为
×100%≈88.1%,
答:此样品中钠的纯度88.1%;
(2)样品中氧化钠的质量5.22g-4.6g=0.62g
则被氧化成氧化钠的金属钠的质量=0.62g×
=0.46g
混合物中n(Na元素)=
=0.22mol,则与水反应生成的总NaOH的物质的量为:n(NaOH)=0.22mol,
溶液质量分数为
×100%≈8.4%,
答:所得溶液溶质的质量分数8.4%.
2Na+2H2O=2NaOH+H2↑
46 2
x 0.2g
| 46 |
| x |
| 2 |
| 0.2g |
x=4.6g
此样品中钠的纯度为
| 4.6g |
| 5.22g |
答:此样品中钠的纯度88.1%;
(2)样品中氧化钠的质量5.22g-4.6g=0.62g
则被氧化成氧化钠的金属钠的质量=0.62g×
| 46 |
| 62 |
混合物中n(Na元素)=
| 4.6g+0.46g |
| 23g/mol |
溶液质量分数为
| 0.22mol×40g/mol |
| 5.22g+100g-0.2g |
答:所得溶液溶质的质量分数8.4%.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列实验方法能达到目的是( )
| A、用氨水清洗试管内壁附着的银镜 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列途径制取:

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )
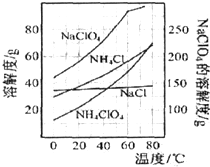

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )

| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
下列各项叙述中,正确的是( )
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |
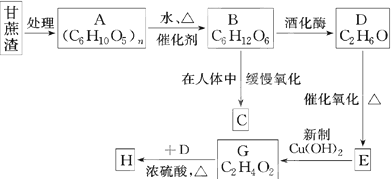
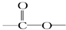 链状结构的同分异构体最多有
链状结构的同分异构体最多有