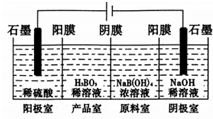
题目内容
9.请回答:(1)Na2O2的电子式
 .
.(2)泡沫灭火器中的离子反应式Al3++HCO3-═Al(OH)3↓+CO2↑.
(3)写出甲醇燃料电池在碱性氢氧化钾中负极方程式:2CH3OH-12e-+12OH-═2CO2↑+10H2O.
(4)完成以下氧化还原反应的离子反应方程式:
2CrI3+27Cl2+64KOH→2K2CrO4+6KIO4+54KCl+32H2O.
分析 (1)过氧化钠为离子化合物,含离子键、共价键;
(2)硫酸铝与碳酸氢钠发生相互促进水解反应生成二氧化碳可灭火;
(3)负极上甲醇失去电子,在碱性电解质中生成碳酸根离子;
(4)Cr元素的化合价由+3价升高为+6价、I元素的化合价由-1价升高为+7价,Cl元素的化合价由0降低为-1价,结合电子、原子守恒配平.
解答 解:(1)Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(2)泡沫灭火器中的离子反应式为Al3++HCO3-═Al(OH)3↓+CO2↑,故答案为:Al3++HCO3-═Al(OH)3↓+CO2↑;
(3)甲醇燃料电池中,负极上甲醇失去电子,则在碱性氢氧化钾中负极方程式为2CH3OH-12e-+12OH-═2CO2↑+10H2O,
故答案为:2CH3OH-12e-+12OH-═2CO2↑+10H2O;
(4)Cr元素的化合价由+3价升高为+6价、I元素的化合价由-1价升高为+7价,Cl元素的化合价由0降低为-1价,由电子、原子守恒配平化学反应方程式为2CrI3+27Cl2+64KOH=2K2CrO4+6KIO4+54KCl+32H2O,故答案为:2;27;64KOH;2;6;54;32H2O.
点评 本题考查较综合,综合考查化学用语,为高频考点,把握化电子式、离子反应、电极反应及氧化还原反应配平为解答的关键,侧重分析与应用能力的考查,注意反应原理及化学用语的结合,题目难度不大.

练习册系列答案
相关题目
19.对于可逆反应M+N?Q 达到限度的标志是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | M、N、Q三种物质的浓度不再变化 | D. | 反应已经停止 |
20.下列说法中正确的是( )
| A. | 苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 | |
| B. | 凡是分子中有-OH的化合物都是醇 | |
| C. | 苯酚是一种弱酸,滴加指示剂变色 | |
| D. | C6H5-OH与C6H5-CH2OH互为同系物 |
17.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2S | |
| D. | NH4Cl (NH4)2SO4 Na2S NaNO3 |
14.已知常温下,醋酸和NH3•H2O的电离平衡常数均为1.74×10-5 mol•L-1,将醋酸与碳酸氢钠溶液混合后会发生反应:CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O,下列说法正确的是( )
| A. | NH3•H2O加水稀释的过程中,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{2}•{H}_{2}O)}$减小 | |
| B. | 将10mL浓度均为0.1mol•L-1的CH3COOH和NH3•H2O混合后,c(NH4+)=c(CH3COO-) | |
| C. | NH4HCO3溶液中离子大小关系为:c(HCO3-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向醋酸中滴加氨水至过量的过程中,水的电离度一直在增大 |
1.下列说法不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 米饭在咀嚼时产生甜味的原因是淀粉的水解 | |
| C. | 油脂是人体必需的营养物质之一 | |
| D. | 工业上常利用蛋白质的水解反应来制取肥皂 |
17.下列元素中,最高正化合价数值最大的是( )
| A. | Si | B. | N | C. | O | D. | F |