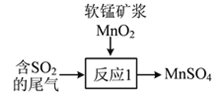
��Ŀ����
����Ŀ��ˮ�����л�������нϸߵĻ�ѧ����������������KMnO4�����л�����京������Ҫ�����������£� 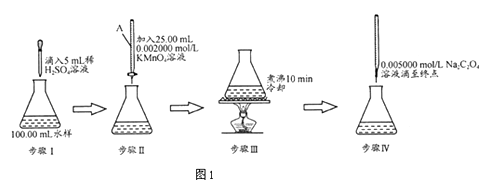
��1������AΪ������ʽ���ʽ���ζ��ܣ�Ҫ˳�����ʵ�飬���������Һ��ɫӦΪ��
��2�����Ʋ�����漰�����ӷ���ʽ��
C2O42��+MnO4��+H+�TMn2++CO2��+��
�ò����е����һ��Na2C2O4ʱ��ɫ�������Ժ�ĵζ�����ɫ�Ͽ죬��ԭ����
��3���������������Na2C2O4��ҺΪ20.00mL����֪�ζ����Һ����ͼ��ʾ������ͼ2�б���ζ�ǰ��Һ�森 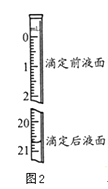
��4����ʵ����������ʵ���л��ﺬ��ƫ�ߣ��ֱ����������������룺
����1��ˮ����Cl��Ӱ��
����2������Na2C2O4��Һ����ʱ��
��5��������1��������������Ͽ�Ƭ������������ʵ��������Cl��Ӱ�죮����ѡ�Լ���AgNO3��Һ��Ag2SO4��Һ��KMnO4��Һ��Na2C2O4��Һ�� ��
���Ͽ�Ƭ��
���л��ʿ�HNO3������
��AgCl��������KMnO4��Һ��Ӧ
��Ag2C2O4�ɱ�����KMnO4��Һ������
���𰸡�
��1����ʽ���Ϻ�ɫ
��2��5��2��16��2��10��8H2O���淴Ӧ����Mn2+��������Ӧ�Ĵ���
��3��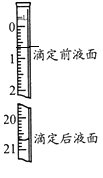
��4�����ӿ̶���
��5��������ˮ���м���������Ag2SO4��Һ
�������� �⣺��1������AΪ�����������ĵζ���Ϊ��ʽ�ζ��ܸ��������Һ�ζ������һ����Һ���Ϻ�ɫ�Ұ���Ӳ���˵����Ӧ�ﵽ�յ㣬��Һ���Ϻ�ɫ�����������Һ��ɫӦΪ�Ϻ�ɫ�����Դ��ǣ���ʽ���Ϻ�ɫ����2��̼Ԫ�ػ��ϼ�+3�۱仯Ϊ+4�ۣ���������ԭ������Ԫ�ػ��ϼ�+7�۱仯Ϊ+2�ۣ�C2O42��ǰ��ϵ��5��MnO4��ǰϵ����2�������غ㡢����غ㡢ԭ���غ���ƽд�����ӷ���ʽΪ��5C2O42��+2MnO4��+16H+=2Mn2++10CO2��+8H2O���ò����е����һ��Na2C2O4ʱ��ɫ�������Ժ�ĵζ�����ɫ�Ͽ죬˵����Ӧ�����ɵ������ӶԷ�Ӧ���������ã����Դ��ǣ�5��2��16��2��10��8H2O���淴Ӧ����Mn2+��������Ӧ�Ĵ����� Na2C2O4��ҺΪ20.00mL����ζ��ܶ���Ϊ��  ���Դ��ǣ�
���Դ��ǣ�  ����4��ʵ����������ʵ���л��ﺬ��ƫ�ߣ�����Na2C2O4��Һ����ʱ�������Ƕ�ȡ����ʱ�ѵζ�����������Һ��������ˣ�
����4��ʵ����������ʵ���л��ﺬ��ƫ�ߣ�����Na2C2O4��Һ����ʱ�������Ƕ�ȡ����ʱ�ѵζ�����������Һ��������ˣ�
���Դ��ǣ����ӿ̶��ߣ���5�����л��ʿ�HNO3����������AgCl��������KMnO4��Һ��Ӧ����Ag2C2O4�ɱ�����KMnO4��Һ������ AgNO3��Һ��������Һ���γ�ϡ������������ԣ��ʲ����ϣ� Ag2SO4��Һ���������������Ȼ����ܽ��С����ת��������������Ӱ�죻 KMnO4��Һ���������ԣ���������Ӱ�죻 Na2C2O4��Һ���Ա����������Һ��������������������Cl��Ӱ���ڲ�����ˮ���м���������Ag2SO4��Һ�����Դ��ǣ�������ˮ���м���������Ag2SO4��Һ��