题目内容
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2→2CO2+4H2O.下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1mol CH3OH完全反应转移12mol电子 ⑤正极反应:O2+4e-+2H2O═4OH- ⑥该电池的电解质溶液可能是碱液.其中正确的是( )
| A、①②⑥ | B、②③④⑤ |
| C、③ | D、①③ |
考点:化学电源新型电池
专题:电化学专题
分析:在燃料电池中,燃料是通入负极,甲醇在负极被氧化,氧气通入正极,在正极得电子被还原,在酸性环境下,正极反应式为O2+4e-+4H+=2H2O,电池总反应式为2CH3OH+3O2=2CO2+4H2O,转移电子是12mol,以此解答该题.
解答:
解:①在燃料电池中,燃料是通入负极,甲醇是负极,故正确;
②在原电池中,H+向正极移动,故错误;
③燃料是通入负极,甲醇在负极被氧化,在酸性环境下,负极反应:CH3OH-6e-+H2O=CO2+6H+,故正确;
④电池总反应式为2CH3OH+3O2=2CO2+4H2O,转移电子是12mol,即1mol CH3OH完全反应转移6mol电子,故错误;
⑤在酸性环境下,正极反应式为O2+4e-+4H+=2H2O,故错误;
⑥该电池的电解质溶液不可能是碱液,溶液中含有质子,故错误.
故选D.
②在原电池中,H+向正极移动,故错误;
③燃料是通入负极,甲醇在负极被氧化,在酸性环境下,负极反应:CH3OH-6e-+H2O=CO2+6H+,故正确;
④电池总反应式为2CH3OH+3O2=2CO2+4H2O,转移电子是12mol,即1mol CH3OH完全反应转移6mol电子,故错误;
⑤在酸性环境下,正极反应式为O2+4e-+4H+=2H2O,故错误;
⑥该电池的电解质溶液不可能是碱液,溶液中含有质子,故错误.
故选D.
点评:本题考查原电池知识,题目难度中等,解答本题的关键是根据电子电解质环境确定电极反应式书写,这也是易错点.

练习册系列答案
相关题目
菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法不正确的是( )
| A、“两者同食”发生的反应中维生素C作还原剂 |
| B、五价砷在维生素C作用下发生了还原反应 |
| C、河虾中含有的五价砷,没有毒性 |
| D、可以推测砒霜中所含的砷元素化合价为+5 |
下列说法正确的是( )
| A、易溶于水的物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相溶的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |
玻璃棒是化学实验中常用的仪器,下列实验操作过程中不需要使用玻璃棒的是( )

| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液 |
| B、从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl |
| C、用pH试纸测定某Na2CO3溶液的pH 值 |
| D、配制75%酒精溶液100g |
某固体物质A在一定条件下受热分解产物都是气体,有关的化学方程式为:2A═B↑+2C↑+2D↑.若生成的混合气体对氘气的相对密度为d,则A的相对分子质量为( )
| A、2d | B、2.5d |
| C、5d | D、10d |




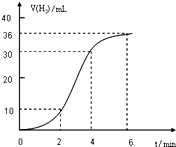 在试管中加入一定量的盐酸和Al条,H2体积随时间变化的图象如图,该实验结果中能说明“温度越高,反应速率越快”的事实是
在试管中加入一定量的盐酸和Al条,H2体积随时间变化的图象如图,该实验结果中能说明“温度越高,反应速率越快”的事实是