题目内容
6.下列对离子化合物的叙述不正确的是( )①离子化合物一定是含有离子键的化合物
②离子化合物一定是由金属元素和非金属元素组成的
③离子化合物熔点高,加热一定难分解
④离子化合物中可能含有共价键,也可能不含共价键.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
分析 ①含离子键的一定为离子化合物;
②离子化合物中可能均为非金属元素;
③离子化合物的熔点较高,但加热可能分解;
④离子化合物一定含离子键,可能含共价键.
解答 解:①含离子键的一定为离子化合物,则离子化合物一定是含有离子键的化合物,故正确;
②离子化合物中可能均为非金属元素,如铵盐中不含金属元素,故错误;
③离子化合物的熔点较高,但加热可能分解,如碳酸氢钠加热易分解,故错误;
④离子化合物一定含离子键,可能含共价键,如NaOH中含离子键、共价键,NaCl中只含离子键,故正确;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.塑料的品种很多,用途也各不相同.PP塑料指的是( )
| A. | 聚氯乙烯 | B. | 聚丙烯 | C. | 有机玻璃 | D. | 聚乙烯 |
14.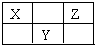 X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
 X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Z | |
| C. | 最高价氧化物的水化物酸性最强的元素为Z | |
| D. | 原子半径由大到小为 Y>Z>X |
1.国际无机化学命名委员会在1989年做出决定,建议把长式元素周期表原先的各族族号取消,由左至右改为18列.如碱金属元素为第1例,稀有气体元素为第18列.据此规定,下列说法错误的是( )
| A. | 第1列和第17列元素的单质熔沸点变化趋势相反 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第15列元素的最高价氧化物为R2O58 | |
| D. | 尚未发现的第113号元素在第七周期第13列 |
11.下列现象与氢键有关的是( )
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
18.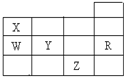 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | 元素原子半径:W<Y | |
| B. | X、Y的阴离子电子层结构都与R原子相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | 常温常压下五种元素的单质中,Z单质的沸点最高 |
15.盐酸与块状CaCO3反应时,不能使反应的最初速率明显加快的是( )
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
16.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm-、Cn-具有相同的电子层结构,且n>m,则下列关系正确的是( )
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |