题目内容
18.在200mL 2mol/L MgCl2溶液中,溶质的质量为38g.此溶液中Cl-的物质的量浓度为4mol/L.分析 根据n=cV计算溶质物质的量,根据m=nM,Cl-的物质的量浓度为MgCl2浓度的2倍,由此分析解答.
解答 解:n(MgCl2)=0.2L×2mol/L=0.4mol,所以m=nM=0.4×95=38g,c(Cl-)=2c(MgCl2)=2×2mol/L=4mol/L,故答案为:38g;4mol/L.
点评 本题考查物质的量浓度有关计算,比较基础,注意理解电解质浓度与电解质离子浓度关系.

练习册系列答案
相关题目
9.下列关于元素周期表的说法中,正确的是( )
| A. | 元素族序数一定等于它的最外层电子数 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
13.常温下,在100ml 12mol•L-1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积可能为(不考虑NO2转化为N2O4)( )
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
3.下列说法一定正确的是( )
| A. | 其水溶液导电的一定是离子晶体 | |
| B. | 固态导电的一定是金属晶体 | |
| C. | 共价化合物形成的晶体一定是分子晶体 | |
| D. | 固态不导电、熔融态导电的一定是离子晶体 |
13.在 分子中,位于同一平面上的原子数最多可能是( )
分子中,位于同一平面上的原子数最多可能是( )
 分子中,位于同一平面上的原子数最多可能是( )
分子中,位于同一平面上的原子数最多可能是( )| A. | 17 个 | B. | 18 个 | C. | 19 个 | D. | 20 个 |
 .
.
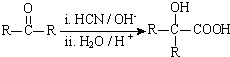 (R、R′代表烃基)
(R、R′代表烃基)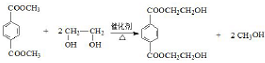 ;
; ;
;