题目内容
关于下列各装置图的叙述中,正确的是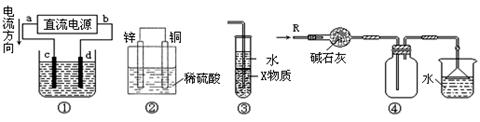
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |
C
解析试题分析:A、由装置图中电流的方向可知a端为正极,c电极为阳极,应为粗铜,b端为负极,d为阴极,d电极应为精铜,错误;B、活泼金属做负极,发生氧化反应,错误;C、X若为四氯化碳,当氨气或氯化氢进入到四氯化碳不发生反应,缓解了导管内气体压强骤然下降的危险,从而起到防止倒吸的作用,正确;D、氨气的密度小于空气,收集瓶内的导管应当是短进长出,即收集瓶内左侧的导管应当短,右侧的导管应当长,错误。
考点:考查电解池、原电池工作原理、化学实验安全中的尾气处理。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用惰性电极电解100mLCuSO4溶液一段时间后,可以通过添加0.1molCu(OH)2将溶液的量与浓度完全复原,则电解时电路中通过的电子为 ( )
| A.0.1mol | B.0.2mol | C.0.4mol | D.0.8mol 1 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
| D.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
如图所示,将铁棒和石墨棒插入饱和食盐水中。下列说法正确的是
| A.甲中铁被保护不会腐蚀 |
| B.甲中正极反应式为4OH--4e- = 2H2O+O2 |
| C.乙中铁电极上发生氧化反应 |
| D.乙中石墨电极附近滴几滴碘化钾淀粉溶液变蓝色 |
下列叙述不正确的是( )
| A.电解法精炼铜时粗铜连接电源的正极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.铜锌原电池中铜电极上发生氧化反应 |
| D.工业上电解饱和食盐水的阳极反应:2Cl- —2e -=Cl2↑ |
图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是( )
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-→2CO32- |
| D.正极反应式为:2CO+2CO32-→4CO2+4e- |
