题目内容
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-→2CO32- |
| D.正极反应式为:2CO+2CO32-→4CO2+4e- |
B
解析试题分析:由题意可知通入CO的一极为负极、失电子,且电极反应式为2CO+2CO32--4e-=4CO2;正极反应式为O2+2CO2+4e-=2CO32-,所以确定A、C、D错误;B项正确。
考点:原电池原理、电极反应式的书写。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
关于下列各装置图的叙述中,正确的是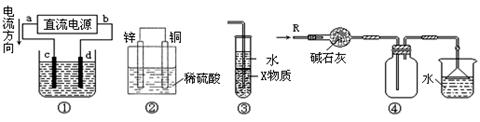
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:
2Al+3 AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是 ( )
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
已知某镍镉(Ni-Cd) 可充电电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
| A.放电时Cd电极发生氧化反应 |
| B.放电时电解质溶液中的OH-向负极移动 |
| C.放电时负极附近溶液的碱性不变 |
| D.充电时阳极反应:Ni(OH)2+OH—+e—=NiOOH+H2O |
如下图,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为 ( )
| A.①②③④⑤ | B.④③②①⑤ | C.④③①②⑤ | D.④②③①⑤ |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
| A.a>c>d>b | B.a>b>c>d |
| C.c>a>b>d | D.b>d>c>a |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷
和氧气,其总反应为:2C2H6+702+8KOH=4K2C03+10H20,有关此电池的推断正确的
是( )。
| A.负极反应为:14H20+702+28e-=280H- |
| B.放电一段时间后,负极周围pH升高 |
| C.每消耗1 mol C2H6,则电路上转移的电子为14 mol |
| D.放电过程中KOH的物质的量浓度不变 |
电池是人类生产、生活中重要的能量来源,各种电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
