题目内容
Ⅰ.CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
(1)常温下中和100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1 V2 (填“>”、“=”或“<”),中和后所得溶液中离子浓度由大到小的顺序为 .
Ⅱ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).
(1)下列能判断反应达到平衡状态的是 .
A.容器中压强不变
B.混合气体密度不变
C.1mol H-H键断裂同时形成2mol H-O
D.H2的体积分数不变
(2)若2min时反应达平衡,此时气体质量增加8g,则用H2表示该反应的反应速率为 .
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为 .
(4)若降低温度,K值减小,则反应的△H 0(填“>”或“<”).
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数 (填“增大”、“减小”或“不变”).
(1)常温下中和100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1
Ⅱ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).
(1)下列能判断反应达到平衡状态的是
A.容器中压强不变
B.混合气体密度不变
C.1mol H-H键断裂同时形成2mol H-O
D.H2的体积分数不变
(2)若2min时反应达平衡,此时气体质量增加8g,则用H2表示该反应的反应速率为
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为
(4)若降低温度,K值减小,则反应的△H
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数
考点:离子浓度大小的比较,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:基本概念与基本理论
分析:Ⅰ.(1)相同温度下,酸的浓度越小其电离程度越大,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比;
醋酸钠是强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断钠离子和醋酸根离子浓度大小;
Ⅱ.(1)当反应前后改变的物理量不变时,该反应达到平衡状态;
(2)根据气体增加的质量与氢气之间的关系计算氢气的平均反应速率;
(3)该温度下的平衡常数K为
;
(4)若降低温度,K值减小,说明正反应是吸热反应;
(5)若反应达平衡后,加入少量的H2,因为反应前后气体体积不变,则再次达到平衡状态时其体积分数不变.
醋酸钠是强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断钠离子和醋酸根离子浓度大小;
Ⅱ.(1)当反应前后改变的物理量不变时,该反应达到平衡状态;
(2)根据气体增加的质量与氢气之间的关系计算氢气的平均反应速率;
(3)该温度下的平衡常数K为
| c4(H2O) |
| c4(H2) |
(4)若降低温度,K值减小,说明正反应是吸热反应;
(5)若反应达平衡后,加入少量的H2,因为反应前后气体体积不变,则再次达到平衡状态时其体积分数不变.
解答:
解:Ⅰ.(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍,100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;
醋酸钠是强碱弱酸盐,其溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>C(CH3COO-),醋酸根离子水解程度很小,所以溶液中离子浓度大小顺序是c(Na+)>C(CH3COO-)>c(OH-)>c(H+),
故答案为:>;c(Na+)>C(CH3COO-)>c(OH-)>c(H+);
Ⅱ.(1)A.无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断是否达到平衡状态,故错误;
B.当混合气体密度不变时,该反应达到平衡状态,故正确;
C.无论反应是否达到平衡状态,都存在1mol H-H键断裂同时形成2mol H-O,所以不能据此判断是否达到平衡状态,故错误;
D.H2的体积分数不变时,该反应达到平衡状态,故正确;
故选BD;
(2)第2min时,气体质量增加8g,则参加反应的氢气的物质的量=
×4=0.5mol,氢气的平均反应速率=
=0.125mol/(L.min),故答案为:0.125mol/(L.min);
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,设氢气的物质的量为xmol、水蒸气的物质的量为ymol,则其平均摩尔质量=
=14g/mol,x:y=1:3,同一容器其浓度之比为1:3,
则该温度下的平衡常数K=(
)4=81,故答案为:81;
(4)若降低温度,K值减小,说明平衡向逆反应方向移动,则正反应是吸热反应,则反应的△H>0,故答案为:>;
(5)若反应达平衡后,加入少量的H2,平衡向正反应方向移动,但反应前后压强不变,所以再次平衡后,H2O的体积分数不变,故答案为:不变.
醋酸钠是强碱弱酸盐,其溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>C(CH3COO-),醋酸根离子水解程度很小,所以溶液中离子浓度大小顺序是c(Na+)>C(CH3COO-)>c(OH-)>c(H+),
故答案为:>;c(Na+)>C(CH3COO-)>c(OH-)>c(H+);
Ⅱ.(1)A.无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断是否达到平衡状态,故错误;
B.当混合气体密度不变时,该反应达到平衡状态,故正确;
C.无论反应是否达到平衡状态,都存在1mol H-H键断裂同时形成2mol H-O,所以不能据此判断是否达到平衡状态,故错误;
D.H2的体积分数不变时,该反应达到平衡状态,故正确;
故选BD;
(2)第2min时,气体质量增加8g,则参加反应的氢气的物质的量=
| ||
| 4 |
| ||
| 2min |
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,设氢气的物质的量为xmol、水蒸气的物质的量为ymol,则其平均摩尔质量=
| 2xg+18yg |
| (x+y)mol |
则该温度下的平衡常数K=(
| 3 |
| 1 |
(4)若降低温度,K值减小,说明平衡向逆反应方向移动,则正反应是吸热反应,则反应的△H>0,故答案为:>;
(5)若反应达平衡后,加入少量的H2,平衡向正反应方向移动,但反应前后压强不变,所以再次平衡后,H2O的体积分数不变,故答案为:不变.
点评:本题考查了弱电解质的电离及化学平衡有关知识,涉及化学平衡常数的计算、化学平衡状态的判断等知识点,只有反应前后改变的物理量才能作为判断化学平衡状态的依据,知道外界条件对可逆反应的影响,注意该可逆反应的特点,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列说法不正确的是( )
| A、2,5-二甲基-3-乙基己烷的实验式:C5H11 |
B、芳香烃M的结构模型为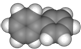 ,则M的结构简式为 ,则M的结构简式为  |
| C、纤维素三硝酸酯的分子式为(C6H7N3O11)n |
D、有机物 中所有原子有可能都在同一平面上 中所有原子有可能都在同一平面上 |
现有三组溶液(1)汽油和氯化钠溶液; (2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液.以上混合溶液分离的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
塑料的使用大大方便了人类的生活,但由此也带来了严重的“白色污染”.下列对废弃塑料制品的处理方法中最为恰当的是( )
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |

 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液. 如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色
如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色
