题目内容
4.下列有关物质结构的说法正确的是( )| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(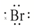 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
分析 A.Na2O2由Na+和O22-构成;
B.溴化氢为共价化合物,氢原子与溴原子形成一对共用电子对,溴化氢中溴原子最外层达到8电子稳定结构,氢原子最外层为2个电子;
C.根据氨气的物质的量以及1个氨气中含有3个N-H键;
D.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构.
解答 解:A.78gNa2O2的物质的量为1mol,而Na2O2由Na+和O22-构成,Na+为2mol,O22-为1mol,故A错误;
B.溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对,溴化氢中氢原子最外层为2个电子,溴原子最外层达到8电子,用小黑点表示原子最外层电子,则溴化氢的电子式为 ,故B错误;
,故B错误;
C.3.4g氨气的物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,1个氨气中含有3个N-H键,所以3.4g氨气中含有0.6NA个N-H键,故C正确;
D.PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构;BCl3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,分子中B原子不满足8电子结构,故D错误;
故选C.
点评 本题主要考查物质的构成、电子式的书写、8电子结构的判断等,难度不大,注意物质的结构与性质的有关知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.由1-丙醇制取 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )
①氧化 ②还原 ③取代 ④加成 ⑤消去 ⑥中和 ⑦缩聚 ⑧酯化.
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )①氧化 ②还原 ③取代 ④加成 ⑤消去 ⑥中和 ⑦缩聚 ⑧酯化.
| A. | ②④⑥⑦⑧ | B. | ⑤④③①⑧ | C. | ①⑤④③⑧ | D. | ②①⑤③⑥ |
13.某元素最高正价氧化物对应的水化物的化学式是HnXOm,该元素的气态氢化物的化学式为( )
| A. | HnX | B. | H(2m-n)X | C. | H(8+n-2m) X | D. | H(8+2m-n) X |
14.下列物质中,属于共价化合物的是( )
| A. | NH4Cl | B. | SO2 | C. | Cl2 | D. | Na2SO4 |
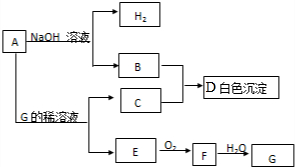
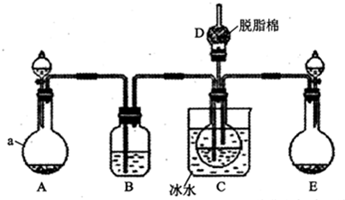

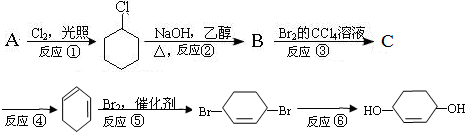
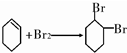
 .
.