题目内容
实验室常用不含Fe3+的FeSO4溶液与NaOH溶液反应制备Fe(OH)2.
(1)用FeSO4晶体配制上述FeSO4溶液时还需加入 来防止Fe2+被氧化,配制时所需的蒸馏水常采用 的方法除去溶解的O2,检验所配FeSO4溶液中不含有Fe3+的最佳试剂是 .
(2)Fe(OH)2露置在空气中容易被氧化,试写出该反应的化学方程式并用单线桥法表示该反应的电子转移情况
;为防止Fe(OH)2氧化,实验时可在FeSO4溶液中加入适量的 (选填“煤油”或“四氯化碳”)来隔绝空气.
(1)用FeSO4晶体配制上述FeSO4溶液时还需加入
(2)Fe(OH)2露置在空气中容易被氧化,试写出该反应的化学方程式并用单线桥法表示该反应的电子转移情况
考点:铁及其化合物的性质实验
专题:实验设计题
分析:(1)根据FeSO4易被空气中的氧气氧化和易水解的特点分析,气体的溶解度随温度的升高而减小;KSCN溶液可以用来检验铁离子;
(2)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁,根据化合价的升降来标电子转移情况,
(2)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁,根据化合价的升降来标电子转移情况,
解答:
解:(1)根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止 生水解反应,同时加入铁屑防止硫酸亚铁被氧化;蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去,检验所配FeSO4溶液中不含有Fe3+的最佳试剂是KSCN溶液,遇到硫氰化钾显示红色,
故答案为:铁屑;煮沸;KSCN溶液;
(2)生成的Fe(OH)2沉淀接触O2,可以发生反应生成氢氧化铁,化合价升高的是Fe元素,化合价降低的元素是氧元素,电子转移为: ,实验时可在FeSO4溶液中加入适量的煤油将之液封,防止变质,故答案为:
,实验时可在FeSO4溶液中加入适量的煤油将之液封,防止变质,故答案为: ;煤油.
;煤油.
故答案为:铁屑;煮沸;KSCN溶液;
(2)生成的Fe(OH)2沉淀接触O2,可以发生反应生成氢氧化铁,化合价升高的是Fe元素,化合价降低的元素是氧元素,电子转移为:
 ,实验时可在FeSO4溶液中加入适量的煤油将之液封,防止变质,故答案为:
,实验时可在FeSO4溶液中加入适量的煤油将之液封,防止变质,故答案为: ;煤油.
;煤油.
点评:实验方案的设计与评价是化学考查的热点题目之一,难度较大,要加强练习,透彻理解教材上的实验原理,掌握方案设计的基本思路和方法,注重培养对比分析的思维能力,问题便会迎刃而解.

练习册系列答案
相关题目
香兰素是重要的香料之一,它可由丁香酚经多步反应合成,有关上述两种化合物的说法正确的是( )
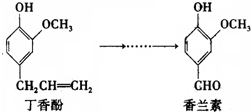

| A、香兰素分子中至少有12个原子共平面 |
| B、丁香酚不能与三氯化铁溶液发生显色反应 |
| C、1mol香兰素最多能与3mol氢气发生加成反应 |
| D、常温下1mol丁香酚只能与1molBr2反应 |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CH4和SiH4的熔点 |
| B、I2在H2O中的溶解能力和I2在CCl4中的溶解能力 |
| C、H2SO3和H2SO4的酸性 |
D、对羟基苯甲醛( )和邻羟基苯甲醛( )和邻羟基苯甲醛( )的沸点 )的沸点 |
设NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、7.1gCl2与足量的铁反应转移电子数目为0.3NA |
| B、17g甲基(-14CH3)中含有的质子数为8NA |
| C、48gO2和O3的混合物含有的原子数为3NA |
| D、100mL0.5 mol/L 的乙酸溶液中分子总数小于0.05NA |
NA代表阿伏伽德罗常数,下列叙述错误的是( )
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | ||
B、1L浓度为1mol?L-1的Na2CO3溶液中含有2NA个
| ||
C、1L 2mol?L-1的BaCl2溶液中
| ||
D、一定温度下,1L0.50mol?L-1NaCl溶液与2L 0.25mol?L-1NaCl溶液含
|
在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确的是 ( )
| A、n(SO42-)>n(NH4+)>n(Al3+)>n(OH-) |
| B、n(Al3+)>n(NH4+)>n(SO42-)>n(H+) |
| C、n(BaSO4)>n[Al(OH)3]>n(NH3?H2O)>n(AlO2-) |
| D、n(NH3?H2O)>n(BaSO4)>n[Al(OH)3]>n(AlO2-) |
下列原子团中,属于烃基的是( )
| A、-CH3 |
| B、-OH |
| C、-COOH |
| D、OH- |
核电站遭破坏会造成放射性物质13153I和13755Cs泄漏.下列说法错误的是( )
| A、每个13755Cs含有82个中子 |
| B、CsOH的碱性比KOH的强 |
| C、HI的还原性比HF的强 |
| D、KIO3是碘的最高价含氧酸的盐 |
 下图是铁粉和水蒸气反应的实验装置示意图
下图是铁粉和水蒸气反应的实验装置示意图