题目内容
下表是周期表的一部分,试回答下列问题
(1)表中元素中,第一电离能最小的元素是
(2)表中元素的最高价氧化物对应水化物中,酸性最强的是
(3)表中ⅦA元素中最不稳定的氢化物是
(4)为什么表中的④第一电离能比⑤大?
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
K
K
(填元素符号,下同),电负性最大的元素是F
F
,单质中化学性质最不活泼的是Ar
Ar
(填化学式).(2)表中元素的最高价氧化物对应水化物中,酸性最强的是
HClO4
HClO4
(填化学式,下同),碱性最强的是KOH
KOH
,呈两性的氢氧化物是Al(OH)3
Al(OH)3
.(3)表中ⅦA元素中最不稳定的氢化物是
HBr
HBr
(填化学式).(4)为什么表中的④第一电离能比⑤大?
镁的外围电子为3S2,处于全满状态,是相对稳定结构
镁的外围电子为3S2,处于全满状态,是相对稳定结构
.分析:由元素在周期表中的位置可知,①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是Ar、⑩是K、⑾是Ca、⑿是Br;
(1)同周期自左而右第一电离能增大,同主族自上而下第一电离能降低,故第一电离能最小的位于左下角;
同周期自左而右电负性增大,同主族自上而下第电负性降低,故第电负性最大的位于右上角;
最不活泼的元素是零族元素单质;
(2)非金属性越强,最高价氧化物对应水化物酸性越强(注意F没有正化合价,没有含氧酸);金属性越强,最高价氧化物对应水化物碱性越强;Al(OH)3是两性氢氧化物;
(3)根据非金属性越强,氢化物越稳定分析,同主族自上而下非金属减弱;
(4)镁的外围电子为3S2,处于全满状态,是相对稳定结构,第一电离能高于同周期相邻元素.
(1)同周期自左而右第一电离能增大,同主族自上而下第一电离能降低,故第一电离能最小的位于左下角;
同周期自左而右电负性增大,同主族自上而下第电负性降低,故第电负性最大的位于右上角;
最不活泼的元素是零族元素单质;
(2)非金属性越强,最高价氧化物对应水化物酸性越强(注意F没有正化合价,没有含氧酸);金属性越强,最高价氧化物对应水化物碱性越强;Al(OH)3是两性氢氧化物;
(3)根据非金属性越强,氢化物越稳定分析,同主族自上而下非金属减弱;
(4)镁的外围电子为3S2,处于全满状态,是相对稳定结构,第一电离能高于同周期相邻元素.
解答:解:由元素在周期表中的位置可知,①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是Ar、⑩是K、⑾是Ca、⑿是Br;
周期表中第ⅦA族后边的族为0族,故答案为:0;
(1)同周期自左而右第一电离能增大,同主族自上而下第一电离能降低,故第一电离能最小是K;
同周期自左而右电负性增大,同主族自上而下第电负性降低,故第电负性最大是F;
最不活泼的元素是零族元素单质Ar,故答案为:K;F;Ar;
(2)F没有正化合价,没有含氧酸,除F外Cl元素的非金属性最强,HClO4的酸性最强;K元素金属性最强,故KOH的碱性最强;Al(OH)3是两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(3)表中ⅦA元素中非金属性F>Cl>Br,故最不稳定的氢化物是HBr,故答案为:HBr;
(4)镁的外围电子为3S2,处于全满状态,是相对稳定结构,第一电离能高于同周期相邻元素,
故答案为:镁的外围电子为3S2,处于全满状态,是相对稳定结构.
周期表中第ⅦA族后边的族为0族,故答案为:0;
(1)同周期自左而右第一电离能增大,同主族自上而下第一电离能降低,故第一电离能最小是K;
同周期自左而右电负性增大,同主族自上而下第电负性降低,故第电负性最大是F;
最不活泼的元素是零族元素单质Ar,故答案为:K;F;Ar;
(2)F没有正化合价,没有含氧酸,除F外Cl元素的非金属性最强,HClO4的酸性最强;K元素金属性最强,故KOH的碱性最强;Al(OH)3是两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(3)表中ⅦA元素中非金属性F>Cl>Br,故最不稳定的氢化物是HBr,故答案为:HBr;
(4)镁的外围电子为3S2,处于全满状态,是相对稳定结构,第一电离能高于同周期相邻元素,
故答案为:镁的外围电子为3S2,处于全满状态,是相对稳定结构.
点评:本题考查元素周期表、元素周期律、常用化学用语等,难度不大,推断元素是解题关键,注意整体把握元素周期表与基础知识的掌握.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下表是周期表的一部分,表中所列的字母分别代表某一化学元素。
| b | | | |||||||||||||||
| | | | | h | | j | | | |||||||||
| a | c | f | | i | | l | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
(2) 将元素a、c、d、f、l、b的原子半径按由大到小的顺序排列________________________。
(3) i元素属于_______________(填金属或非金属)元素,它的最高化合价是____________,
最低化合价是___________。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出i的单质与氧气反应的化学方程式:_________________
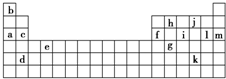 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
