题目内容
5.称取两份质量相同的铝粉,一份加入足量的氢氧化钠溶液中,另一份加入足量的盐酸溶液中,相同条件下,反应放出的氢气的体积为( )| A. | 1:2 | B. | 3:1 | C. | 1:1 | D. | 1:3 |
分析 根据铝与酸、碱反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算判断.
解答 解:铝与酸、碱反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,这两个反应中都是Al作还原剂,根据方程式知,若Al的质量相等,则生成生成的氢气质量相同,即生成氢气的质量之比为1:1,故选C.
点评 本题考查化学方程式有关计算,正确书写方程式是解本题关键,可以利用电子转移守恒解答,题目难度不大.

练习册系列答案
相关题目
18.某工业生产的废液中含有FeCl2、FeCl3、AlCl3、MnCl2,欲从中提取MnCl2,方案如下:加H2O2溶液氧化;调节pH,产生沉淀X;过滤,得MnCl2溶液.已知各金属离子沉淀的pH范围如下:
(1)加入H2O2的目的是将亚铁离子氧化为铁离子;调节pH的范围是4.7~7.8;
(2)向沉淀X中加入NaOH溶液,有关反应的化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O,过滤后将所得沉淀加热后得红棕色固体,写出高温下该固体与金属铝的反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)一定条件下电解含Mn2+的溶液可以制得MnO2,生成MnO2的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,同时在另一极还能获得一种清洁能源是H2.
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
(2)向沉淀X中加入NaOH溶液,有关反应的化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O,过滤后将所得沉淀加热后得红棕色固体,写出高温下该固体与金属铝的反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)一定条件下电解含Mn2+的溶液可以制得MnO2,生成MnO2的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,同时在另一极还能获得一种清洁能源是H2.
20.下列物质之间的反应,会因条件不同而生成不同产物的是( )
| A. | Na与O2反应 | B. | 锌与稀盐酸反应 | C. | Al与O2反应 | D. | CaCO3溶于盐酸 |
14.下列物质的化学式书写正确是( )
| A. | 氯化钠( ClNa ) | B. | 高锰酸钾(K2MnO4) | C. | 硫酸钠(Na2S) | D. | 碳酸(H2CO3) |
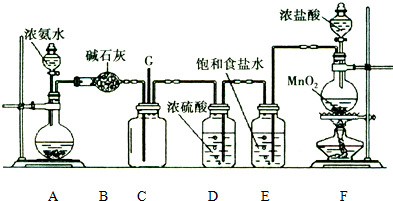


 .
. .
. (或
(或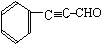 ).
). 、
、 、
、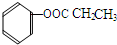 、
、 、
、 、
、 (写结构简式).
(写结构简式).