题目内容
已知14mol/L的硫酸溶液的溶质的质量分数为80%,那么7mol/L的硫酸溶液的溶质的质量分数将( )
| A、大于40% | B、等于40% |
| C、小于40% | D、无法确定 |
考点:溶液中溶质的质量分数及相关计算
专题:
分析:假设14mol/L硫酸溶液密度为a,7mol/L硫酸溶液密度为b,硫酸溶液浓度越大,密度越大,则a<b,结合c=
进行判断.
| 1000ρω |
| M |
解答:
解:假设14mol/L硫酸溶液密度为a,7mol/L硫酸溶液密度为b,质量分数为ω,结合c=
可知,
则:14=
,7=
,故
=
×2,
硫酸溶液浓度越大,密度越大,则a<b,故ω>40%,
故选A.
| 1000ρω |
| M |
则:14=
| 1000a×80% |
| 98 |
| 1000b×ω |
| 98 |
| 1000a×80% |
| 98 |
| 1000b×ω |
| 98 |
硫酸溶液浓度越大,密度越大,则a<b,故ω>40%,
故选A.
点评:本题考查溶液浓度计算,涉及物质的量浓度、质量分数,注意理解掌握物质的量浓度与质量分数之间关系,注意硫酸的浓度越大,密度越大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
关于乙醇结构与性质的说法中正确的是( )
| A、乙醇结构中有-OH,其水溶液可以电离出OH-而显碱性 |
| B、乙醇与乙酸在一定条件下反应生成乙酸乙酯 |
| C、乙醇与钠反应可以产生氢气,所以乙醇显酸性 |
| D、乙醇与钠反应比较平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
能在水溶液中大量共存的一组离子是( )
| A、ClO-、I-、Na+、SO42- |
| B、Al3+、K+、CO32-、Cl- |
| C、K+、Ag+、Ca2+、NO3- |
| D、NH4+、Na+、OH-、MnO4- |
下列关于电解质和非电解质的说法错误的是( )
| A、电解质并不是在任何情况下都能导电 |
| B、不导电的物质不一定是非电解质 |
| C、所有的固态电解质加热后都能电离出离子 |
| D、金属铜能够导电,但不属于电解质也不属于非电解质 |
下列化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、氟原子的结构示意图: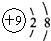 |
C、甲烷的电子式: |
| D、磷酸钠的电离方程式:Na3PO4=Na33++PO43- |
VLFe2(SO4)3溶液中含有a克SO42-的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为( )
| A、a/576V mol?L-1 |
| B、a/125 mol?L-1 |
| C、250a/36V mol?L-1 |
| D、250a/48V mol?L-1 |
设阿伏加德罗常数为NA,标准状况下,m g N2气体含有b个分子,则n g N2在相同状态下的体积为 (单位为L)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列电离方程式不正确的是( )
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na+H++SO 42- |
| C、HNO3=H++NO 3- |
| D、KHCO3=K++H++CO 32- |