题目内容
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度ρg/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A.ρ=(17V+22400)/(22.4+22.4V) B.W=17c/(1000ρ)
C.W=17V/(17V+22400) D.C=1000Vρ/(17V+22400)
【答案】A
【解析】
试题分析:氨气的物质的量是V/22.4 mol,溶液的质量是(17V/22.4)+1000 g,溶液的体积不是(V+1)L,所以选项A不正确,其余都是正确的,答案选A

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
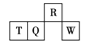
活力试卷系列答案【题目】右表是元素周期表的一部分,其中A、B、D、E、G、J为短周期元素,G元素的核电荷数为B元素的2倍。请回答下列问题:
A | B | ||
D | E | G | J |
L | M | Q |
(1)J的最高价氧化物对应水化物的化学式是___________________。
(2)G2J2常用作橡胶的低温硫化剂和黏结剂,其电子式为_______________________。写出一个能表示元素G、J非金属性强弱关系的化学方程式____________________________。
(3)G单质在空气中燃烧生成一种无色有刺激性气味的气体,该无色有刺激性气味的气体与含1molJ的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在—定条件下反应,可生成一种强酸和一种氧化物,且该反应中有NA个电子转移,则该反应的化学方程式是________________________。
(4)A的最简单氢化物是___________(填“极性”或“非极性”)分子,实验室制备该物质的化学方程式为__________________________________________。
(5)根据元素周期律,可以推测上表中长周期元素的单质具有半导体特性的是__________(填元素符号)。
【题目】某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+ , 该原电池的组成正确的是( )
Zn | A | B | C | D |
正极 | Fe | C(石墨) | Ag | Zn |
负极 | Cu | Fe | Fe | Fe |
电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D