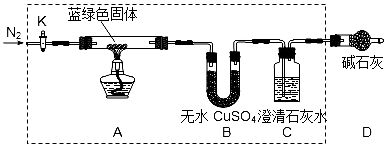
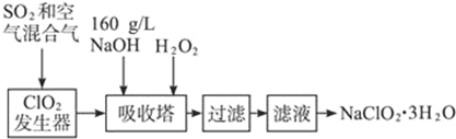
题目内容
1.某固体仅由一种元素组成,其密度为5.0g∕cm3.用X射线研究该固体的结构时得知:在边长为10-7cm的正方体中含有20个原子,则此元素的相对原子质量是多少?分析 根据m=ρV可计算质量,1mol原子的质量在数值上等于其相对原子质量.
解答 解:20个原子的质量为m=ρV=5.0g•cm-3×(1×10-7)3cm3=5×10-21g,所以一个原子的质量为:5×10-21g÷20=2.5×10-22g,则NA个质量为:6.02×1023×2.5×10-22g=150.5g,故摩尔质量为 150.5g/mol,此元素的相对原子质量为150.5.
答:此元素的相对原子质量是150.5.
点评 本题考查相对原子质量的计算方法,注意摩尔质量以g/mol为单位和相对原子质量在数值上相等,难度不大.

练习册系列答案
相关题目
11.化学无处不在,下列与化学有关的说法不正确的是( )
| A. | 食盐可做调味剂,也可做食品防腐剂 | |
| B. | 单质硅是制造太阳能电池和光导纤维的常用材料 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 聚乙烯塑料制品可用于食品的包装 |
12.如表数据是在某温度下,金属镁和镍(Ni)分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
注:a和b均为与温度有关的常数,nm表示“纳米”
请回答:
Mg与Ni比较,哪一种更易氧化?Mg,其理由是氧化镁厚度增加的速度比氧化镍快.如果用Y表示氧化镁膜层厚,用t表示形成氧化薄膜层厚所需时间,Y和t的关系为Y=0.05at,Y=$\sqrt{t}$b.
| 反应时间/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚/nm | 0.05a | 0.2a | 0.45a | 0.8a | 1.25a |
| NiO层厚/nm | b | 2b | 3b | 4b | 5b |
请回答:
Mg与Ni比较,哪一种更易氧化?Mg,其理由是氧化镁厚度增加的速度比氧化镍快.如果用Y表示氧化镁膜层厚,用t表示形成氧化薄膜层厚所需时间,Y和t的关系为Y=0.05at,Y=$\sqrt{t}$b.
9.下列叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 11.2L氯气所含的分子数为0.5NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+的物质的量为0.2mol | |
| D. | 常温常压下,1mol氦气含有的核外电子数为2NA |
16.镁条在空气中燃烧后,其生成的产物可能含有的物质是( )
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
13.现有一定质量的Cu和Cu2O组成的混合物溶于足量浓硫酸中,加热使固体完全溶解,共产生11.2LSO2(标准状况),则该混合物的质量可能是( )
| A. | 32g | B. | 50g | C. | 72g | D. | 80g |